
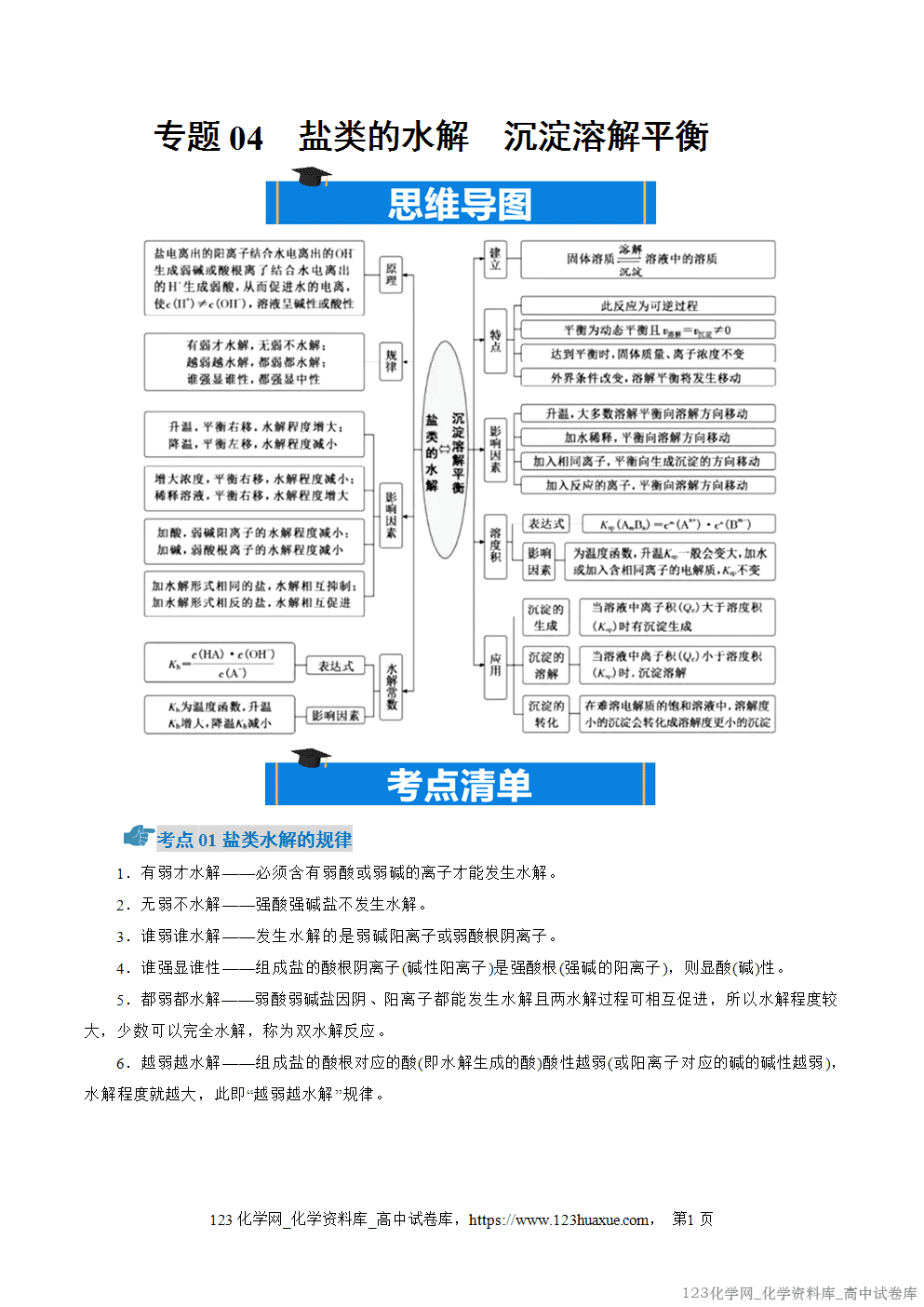








考点01盐类水解的规律
1.有弱才水解——必须含有弱酸或弱碱的离子才能发生水解。
2.无弱不水解——强酸强碱盐不发生水解。
3.谁弱谁水解——发生水解的是弱碱阳离子或弱酸根阴离子。
4.谁强显谁性——组成盐的酸根阴离子(碱性阳离子)是强酸根(强碱的阳离子),则显酸(碱)性。
5.都弱都水解——弱酸弱碱盐因阴、阳离子都能发生水解且两水解过程可相互促进,所以水解程度较大,少数可以完全水解,称为双水解反应。
6.越弱越水解——组成盐的酸根对应的酸(即水解生成的酸)酸性越弱(或阳离子对应的碱的碱性越弱),水解程度就越大,此即“越弱越水解”规律。