
离子晶体
(1)构成粒子:阴离子和阳离子。
(2)作用力:离子键。
(3)配位数:一个离子周围最邻近的异电性离子的数目。
(4)离子晶体结构的决定因素
①几何因素:晶体中正负离子的半径比。
②电荷因素:晶体中正负离子的电荷比。
③键性因素:离子键的纯粹程度。
(5)离子晶体的性质
熔、沸点 | 熔、沸点较高,难挥发 |
硬度 | 硬度较大,难以压缩 |
溶解性 | 一般在水中易溶,在非极性溶剂中难溶 |
导电性 | 固态时不导电,熔融状态或在水溶液中能导电 |
(6)结构模型
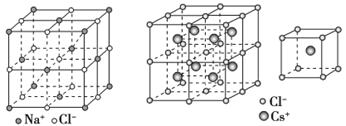
①NaCl型:在晶体中,每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+,配位数为6。每个晶胞含4个Na+和4个Cl-。
②CsCl型:在晶体中,每个Cl-吸引8个Cs+,每个Cs+吸引8个Cl-,配位数为8。
金属晶体
(1)金属键
①概念:金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而把所有金属原子维系在一起。
②成键粒子是金属阳离子和自由电子。
③金属键的强弱和对金属性质的影响:
a.金属键的强弱主要取决于金属元素的原子半径和价电子数,原子半径越大,价电子数越少,金属键越弱;反之,金属键越强。
b.金属键越强,金属的熔、沸点越高,硬度越大。
(2)金属晶体
①在金属晶体中,原子间以金属键相结合。
②金属晶体的性质:优良的导电性、导热性和延展性。
③用电子气理论解释金属的性质: