








(1)基于元素“位置-结构-性质”认识元素性质,基于物质“结构-性质-用途”认识物质性质,基于元素性质递变的本质原因认识物质世界。
(2)加深对分类法、归纳法等科学方法的认识,提高逻辑推理能力、论证能力,从而发展证据推理与模型认知的化学学科核心素养。
【内容分析】
对于中学阶段重要的理论知识,教材编写体现学科知识的逻辑性,重视推理,借助实验和事实进行分析;应用演绎、归纳的方法,培养学生的逻辑思维能力。本节内容在讨论了碱金属元素的金属性、卤族元素的非金属性变化规律,第三周期元素性质的递变规律之后展开,使学生进一步认识“构” “位”“性”的关系。通过学习族和周期元素性质的变化,可以使学生综合认识元素性质的周期性递变规律,从而归纳出元素周期律,了解元素周期表和周期律的应用,对“构”“位”“性”的关系有进一步的认识。
【教学重点和难点】
重点:元素性质与原子结构的关系
难点:元素性质与原子结构的关系
【教学流程】
【思考与讨论】
门捷列夫在他的第一张周期表 上留下的空位中的元素“类铝”于1875年由法国化学家布瓦博德朗发现,并命名为镓,而布瓦博德朗当时并未受到门捷列夫预言的启发。门捷列夫在得知这一发现后指出:他相信镓和“类铝”是同一种物质,并认为镓的密度应该是5.9~ 6.0 g/cm3,而不是布瓦博德朗发表的4.7 g/cm3。当时布瓦博德朗认为只有他本人才拥有镓,门捷列夫怎么会知道这种金属的密度呢?他没有固执已见,重新提纯了镓,最后测得的密度果然是5.94 g/cm'。这一发现使他大为惊讶,他在一篇论文中写道:“我以为没有必要再来说明]捷列夫这一-理论的巨 大意义了。”
(1)阅读上述资料,你得到什么启示?写一篇小论文与同学交流。
①理论指导实践,实践检验理论;
②勇于创新,敢于质疑的科学精神对推动科学进步的作用;
③严谨求实的科学态度在科学实验中的意义
(2)请你查阅资料,了解门捷列夫还预言了哪些新元素,以及当时这些新元素是如何被确认的,撰写研究报告,并与同学交流。
【设计意图】通过化学史,感受元素周期表的魅力,提升学生的学习积极性,落实科学态度和社会责任素养。
【学习任务一】认识元素位、构、性的关系
元素周期律的发现,对化学的发展有很大的影响。作为元素周期律表现形式的元素周期表,反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。
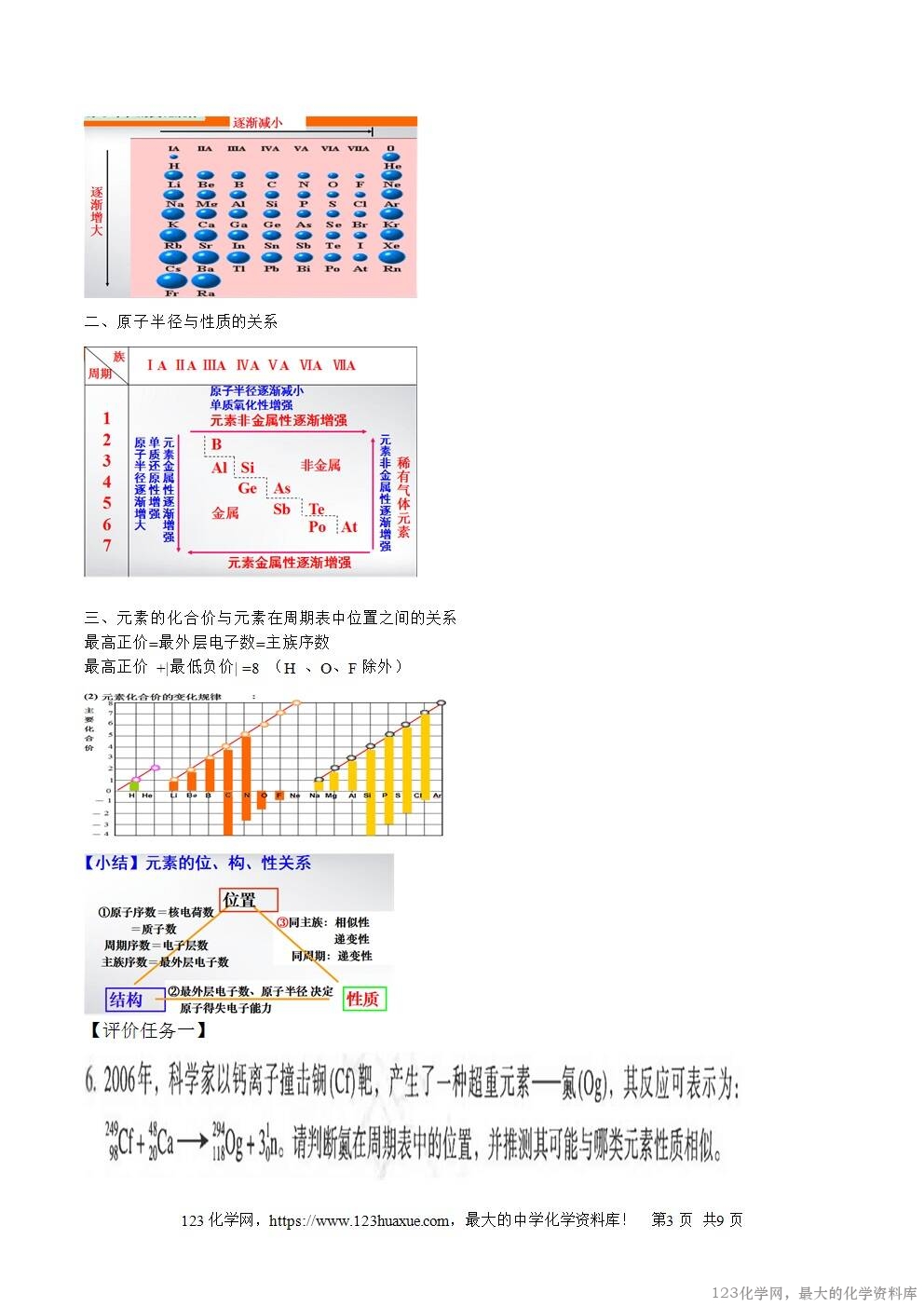
一、原子半径的变化规律
二、原子半径与性质的关系
三、元素的化合价与元素在周期表中位置之间的关系
最高正价=最外层电子数=主族序数
最高正价 +|最低负价| =8 (H 、O、F除外)
【评价任务一】
第七周期,0族元素。与稀有气体元素具有相似的性质,化学性质不活泼,具有放射性。
提示:要记住每一周期有多少种元素,从而根据质子数判断周期位置,再进一步推断族位置。
【设计意图】回顾位构性的关系,落实证据推理和模型认知素养。
【学习任务二】元素周期表和元素周期律的指导作用
1、根据元素在周期表中的位置推测其原子结构和性质
2、根据元素的原子结构推测它在周期表中的位置
3、指导新元素的发现及预测它们的原子结构和性质
4、指导其他与化学相关的科学技术。
在周期表中一定的区域内寻找有特定性质的物质