










第二节 元素周期律
第1课时 元素性质的周期性变化规律
[核心素养发展目标] 1.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化,认识元素周期律并理解其实质。2.会设计实验探究同周期元素性质的变化规律,会比较元素的金属性或非金属性的强弱,促进“证据推理与模型认知”化学核心素养的发展。
一、核外电子排布、原子半径和主要化合价的变化
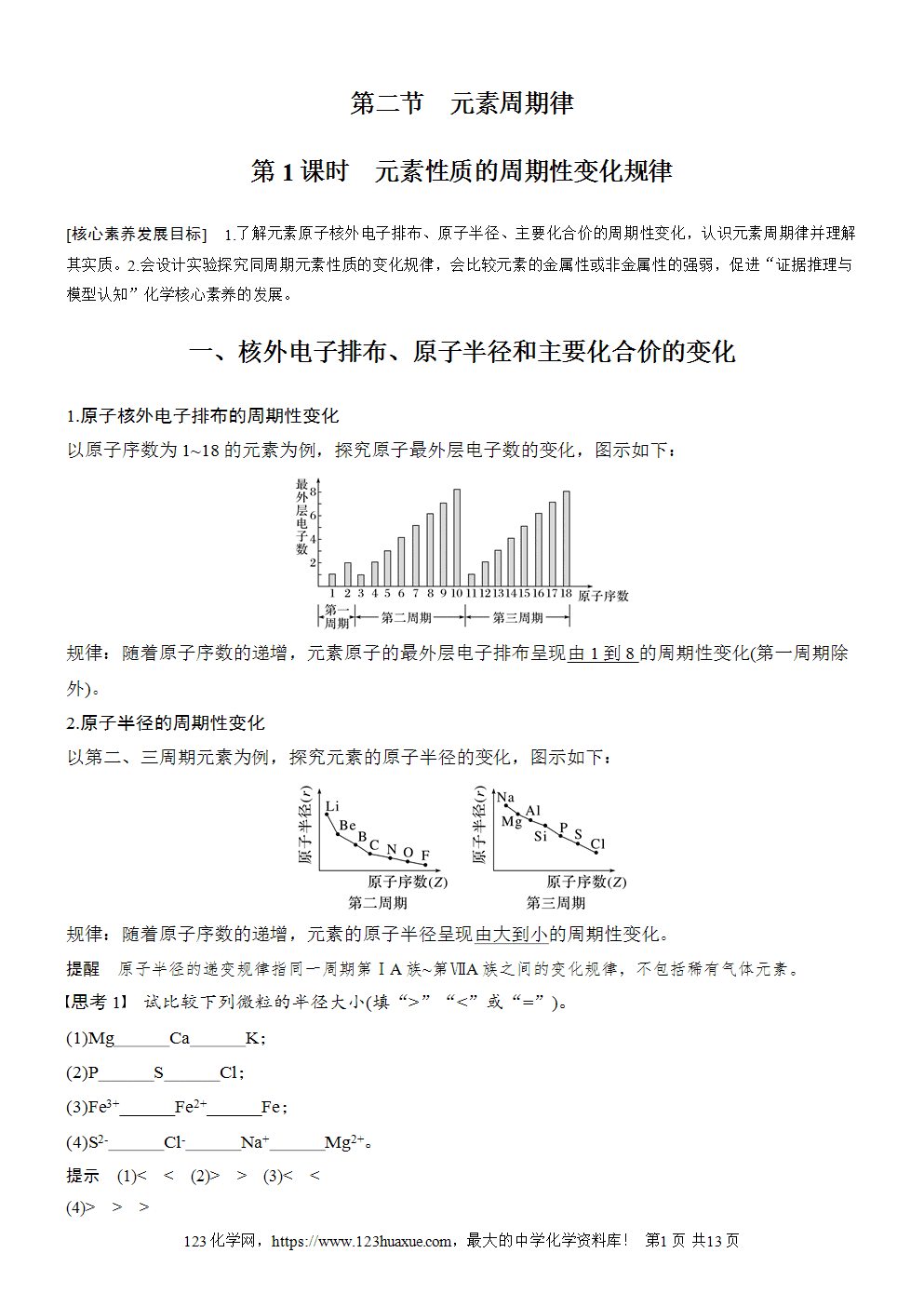
1.原子核外电子排布的周期性变化
以原子序数为1~18的元素为例,探究原子最外层电子数的变化,图示如下:
规律:随着原子序数的递增,元素原子的最外层电子排布呈现由1到8的周期性变化(第一周期除外)。
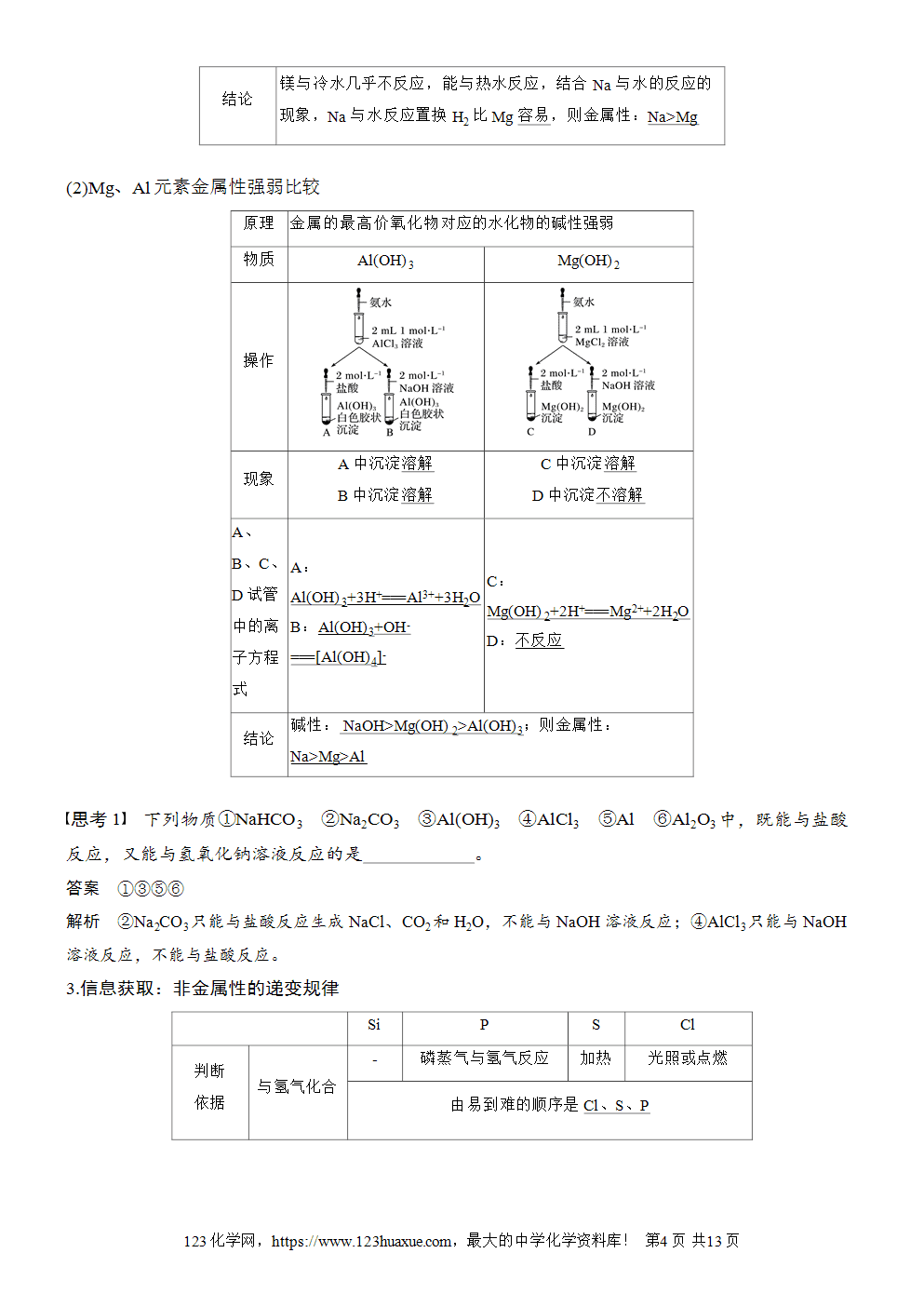
2.原子半径的周期性变化
以第二、三周期元素为例,探究元素的原子半径的变化,图示如下:
规律:随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。
提醒 原子半径的递变规律指同一周期第ⅠA族~第ⅦA族之间的变化规律,不包括稀有气体元素。
思考1 试比较下列微粒的半径大小(填“>”“<”或“=”)。
(1)Mg Ca K;
(2)P S Cl;
(3)Fe3+ Fe2+ Fe;
(4)S2- Cl- Na+ Mg2+。
提示 (1)< < (2)> > (3)< <
(4)> > >
“三看法”比较微粒半径的大小
一看层,层多径大;
二看核,层同核多径小;
三看电子,层同核同电子多径大,如Cl->Cl、Fe2+>Fe3+。
3.元素化合价的周期性变化
以原子序数为1~18的元素为例,探究元素化合价的变化,图示如下:
规律:随着原子序数的递增,元素的化合价呈周期性变化,即每周期,最高正价为+1→+7(O无最高正价、F无正价),负价为-4→-1。
思考2 主族元素的最高化合价等于其族序数,这句话对吗?为什么?
提示 不对。主族元素形成最高化合价时,失去(或偏移)最外层的全部电子达到稳定结构,但O、F元素因原子半径很小,非金属性很强,所以在反应中不能失去(或偏移)最外层的全部电子,故O元素没有最高正化合价、F元素无正价。
主族元素主要化合价的确定方法
(1)最高正价=主族序数=最外层电子数(O、F除外)。
(2)最低负价=最高正价-8(H、O、F除外)。
(3)H的最高价为+1,最低价为-1;O最低价为-2;F无正化合价,最低价为-1。
1.判断正误
(1)第二周期元素从左至右,最高正价从+1递增到+7( )
(2)原子半径最小的元素是氢元素( )
(3)氢元素除了有+1价外,也可以有-1价,如NaH( )
(4)主族元素的最低负价等于其族序数-8( )
(5)第三周期原子半径最大的元素为钠( )
答案 (1)× (2)√ (3)√ (4)× (5)√
2.下列说法正确的是( )
A.原子序数越大,原子半径一定越大
B.电子层数多的原子半径一定比电子层数少的原子半径大
C.元素性质的周期性变化不是元素性质的简单重复
D.按C、N、O、F的顺序,元素的最高正化合价依次升高
答案 C
解析 氯原子比锂原子多一个电子层,但原子半径:r(Li)>r(Cl),故B错误;元素性质的周期性变化不是简单的重复,变化的程度不同,变化的起点和终点也不同,故C正确;氟是最活泼的非金属元素,它只有负化合价,没有正化合价,故D项错误。
3.(2024·海口长流中学高一月考)若某非金属元素X的最高价氧化物对应的水化物的化学式为HnXOm,则X元素的族序数为 ,它的最高价氧化物的化学式为 ,氢化物的化学式为 。
答案 2m-n X2O2m-n H(8-2m+n)X
解析 HnXOm中H为+1价,O为-2价,则X为+(2m-n)价,元素的主族序数等于最外层电子数,则X元素的族序数为2m-n;它的最高价氧化物的化学式为X2O2m-n,其最低负价为2m-n-8=-(8-2m+n),则其氢化物为H(8-2m+n)X。