


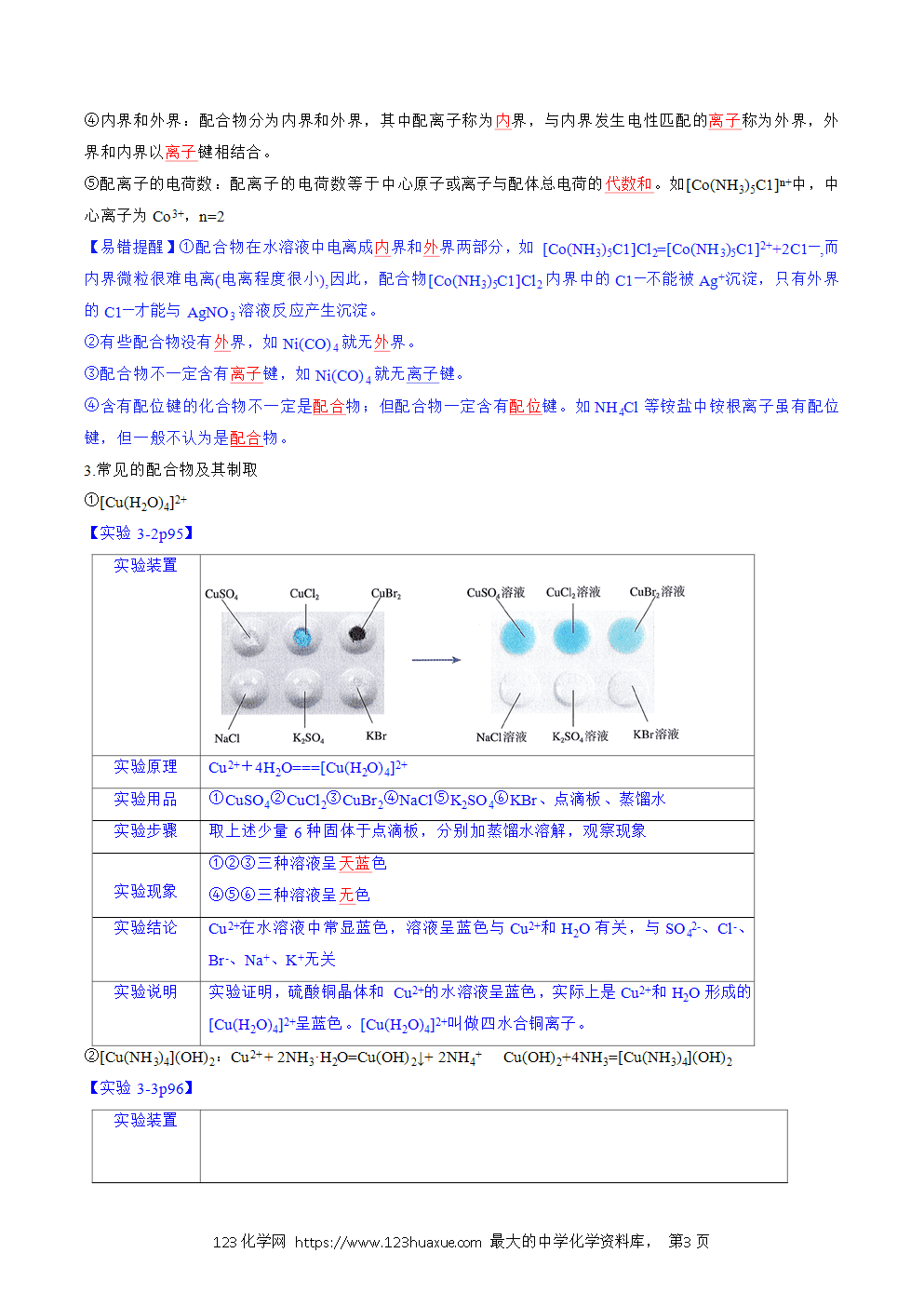

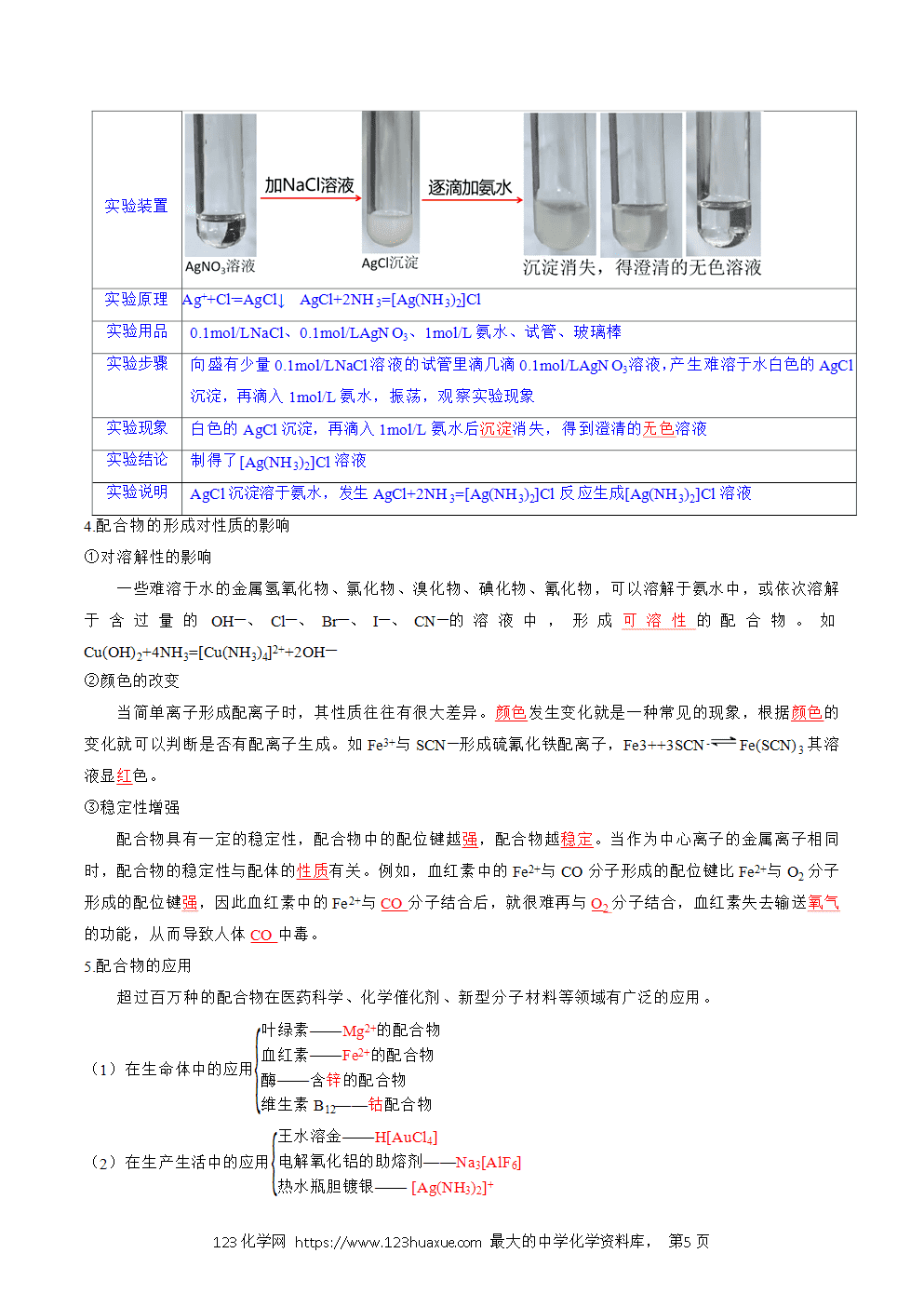







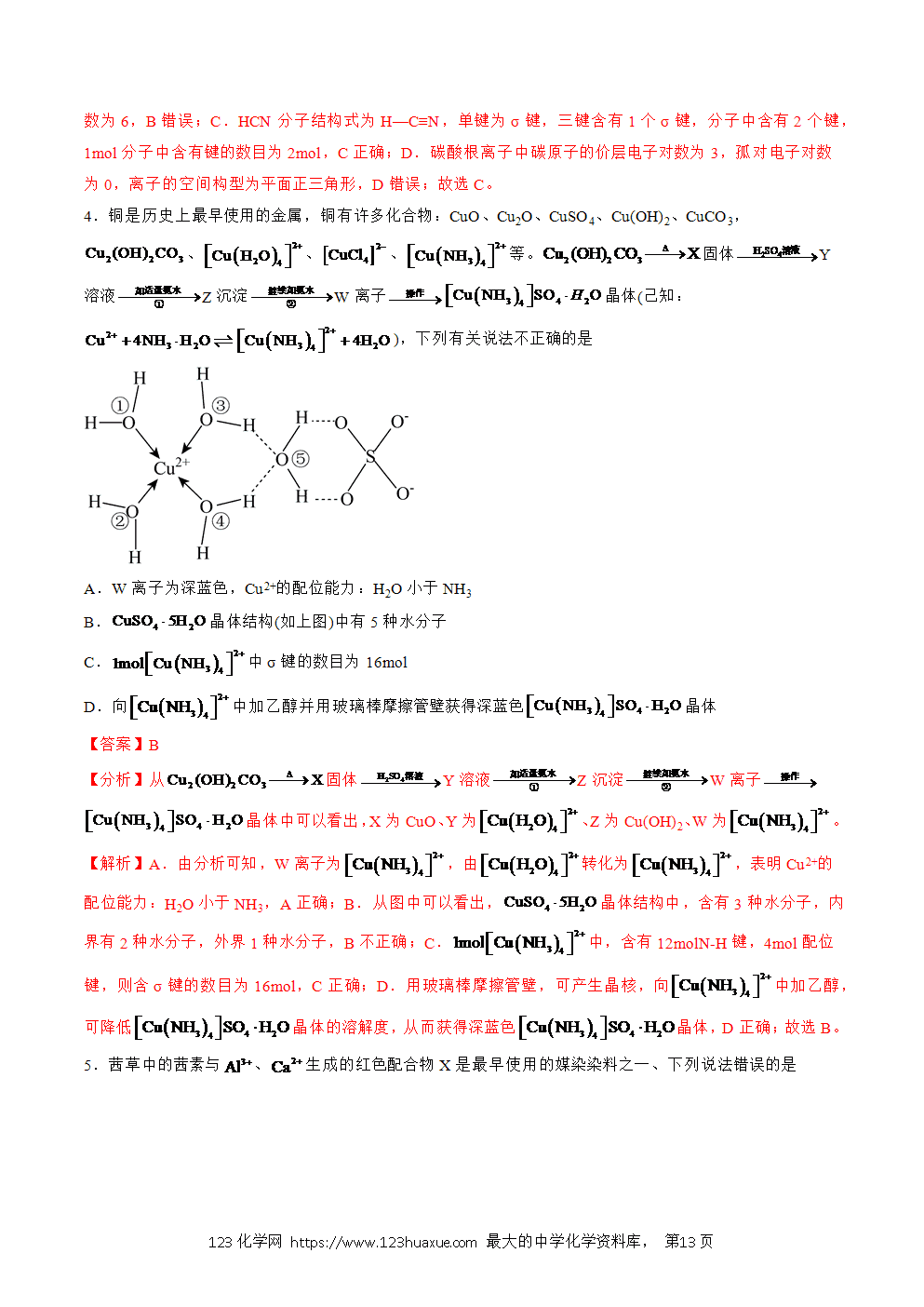
一、配位键
1.定义:成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的共价键,这类“电子对给予—接受”键被称为配位键。提供空轨道的原子或离子称为中心原子或中心离子,提供孤电子对的原子对应的分子或离子称为配体或配位体。例如:[Cu(H2O)4]2+,Cu2+是中心离子,H2O是配体。
2.形成条件
①成键原子一方能提供孤电子对。
②成键原子另一方能提供空轨道。
如反应NH3+H+=NH4+,NH3中的N上有1对孤电子对,H+中有空轨道,二者通过配位键结合形成NH4+, NH4+的形成可表示如下:
【易错提醒】①孤电子对:分子或离子中,没有跟其他原子共用的电子对就是孤电子对。如分子中中心原子分别有1、2、3个孤电子对。含有孤电子对的微粒:分子如CO、NH3、H2O、有机胺等分子,离子如SCN—、Cl—、CN—、NO2—等。
②含有空轨道的微粒:过渡金属的原子或离子。一般是过渡金属的原子或离子如:Fe3+、Cu2+、Zn2+、Ni2+、Co3+、Ni ; 还有H+、Al3+、B、Mg2+等主族元素原子或离子。一般来说,多数过渡金属的原子或离子形成配位键的数目基本上是固定的,如Ag+形成2个配位键,Cu2+形成4个配位键等。
3.表示方法