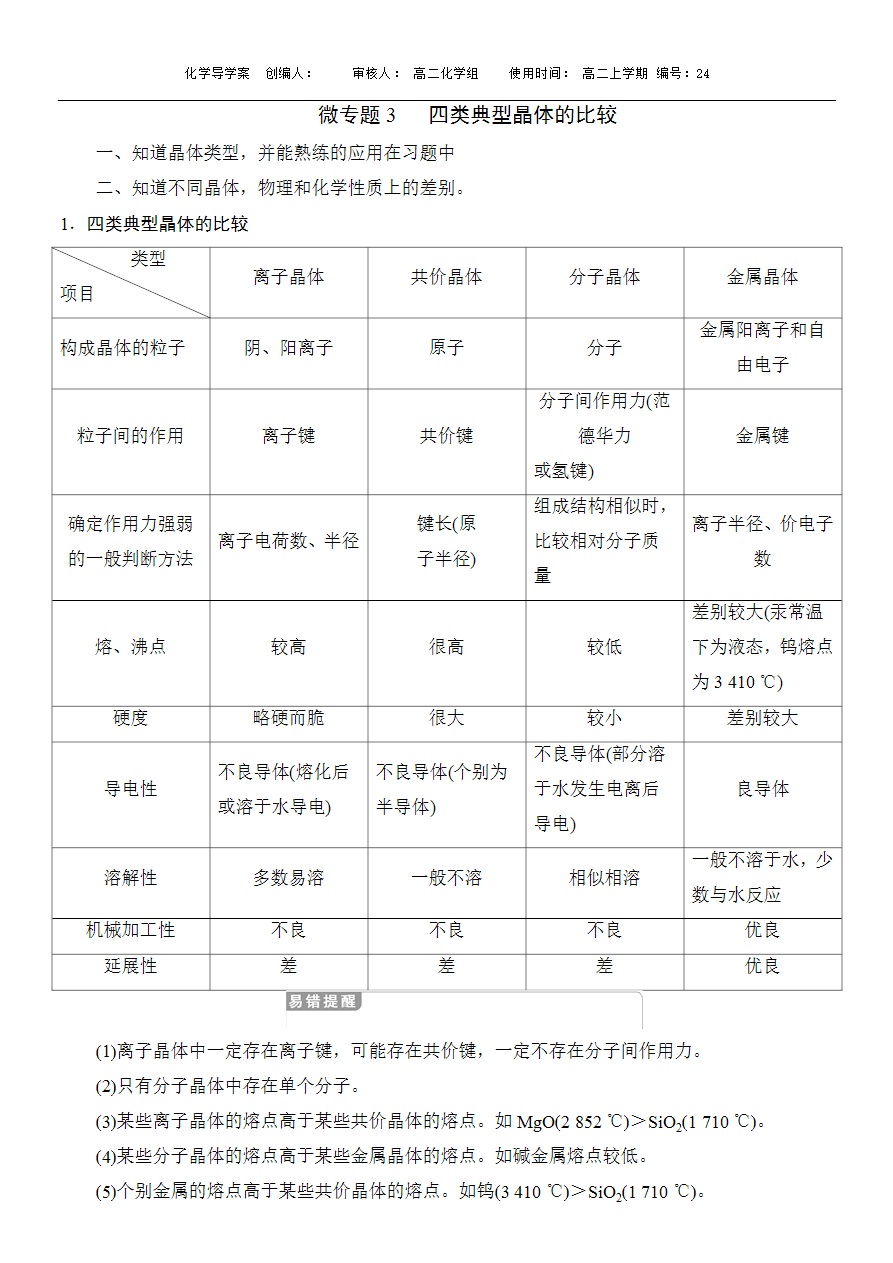
(1)离子晶体中一定存在离子键,可能存在共价键,一定不存在分子间作用力。
(2)只有分子晶体中存在单个分子。
(3)某些离子晶体的熔点高于某些共价晶体的熔点。如MgO(2 852 ℃)>SiO2(1 710 ℃)。
(4)某些分子晶体的熔点高于某些金属晶体的熔点。如碱金属熔点较低。
(5)个别金属的熔点高于某些共价晶体的熔点。如钨(3 410 ℃)>SiO2(1 710 ℃)。
(6)合金的熔点一般低于成分金属的熔点。
2.晶体熔、沸点高低的比较方法
(1)不同类型晶体熔、沸点的比较:
①不同类型晶体的熔、沸点高低一般规律:共价晶体>离子晶体>分子晶体。
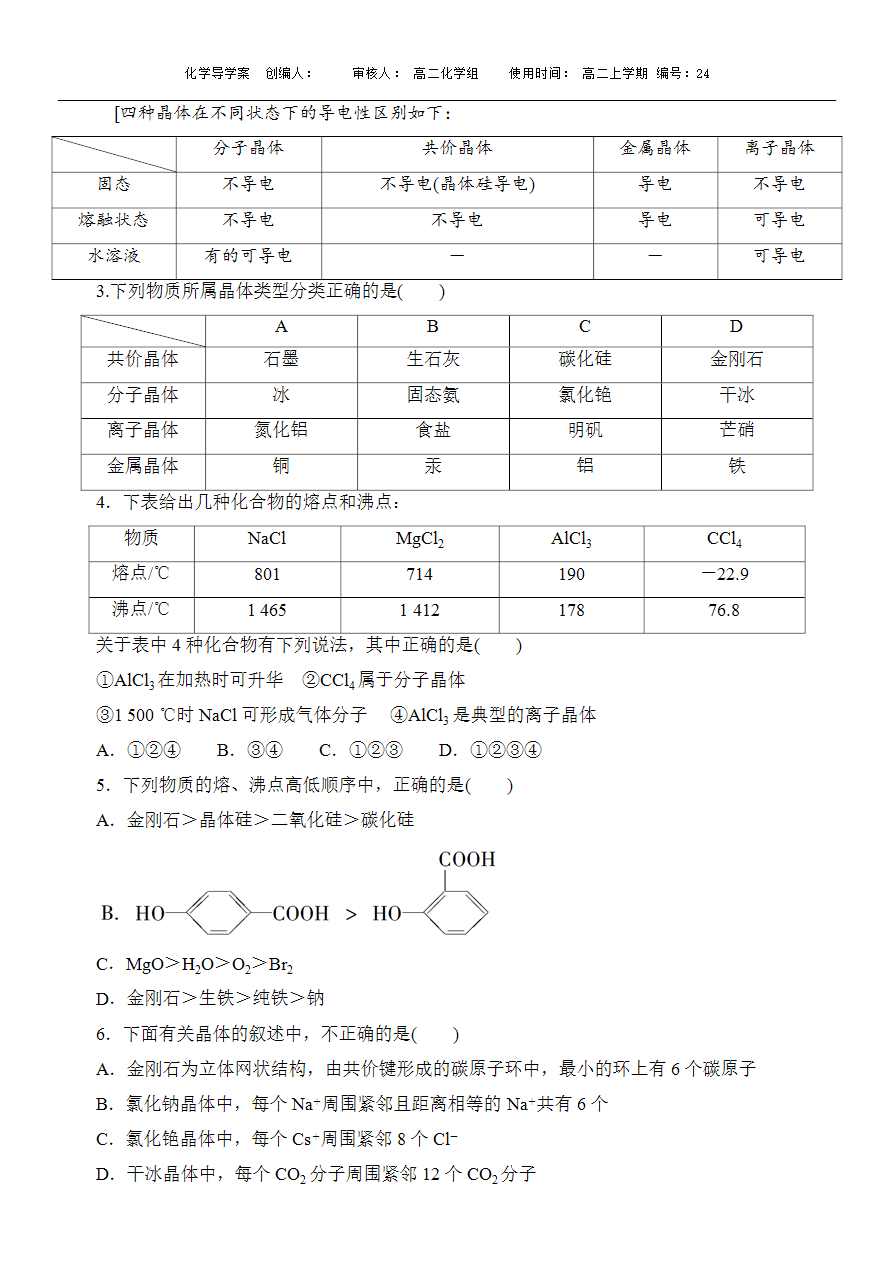
②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)同种类型晶体熔、沸点的比较:
①共价晶体
原子半径越小→键长越短→键能越大→熔、沸点越高。如熔点:金刚石>硅晶体。
②离子晶体
一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高。如熔点:MgO>NaCl>CsCl。
③分子晶体
a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高。如沸点:H2O>H2Te>H2Se>H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。如熔、沸点:SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如熔、沸点:CO>N2,CH3OH>CH3CH3。
④金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。如熔、沸点:Na<Mg<Al。