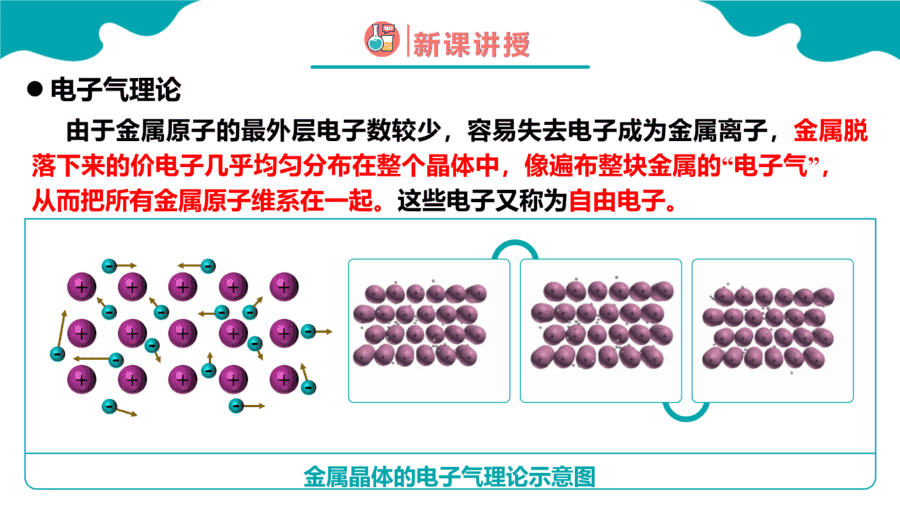
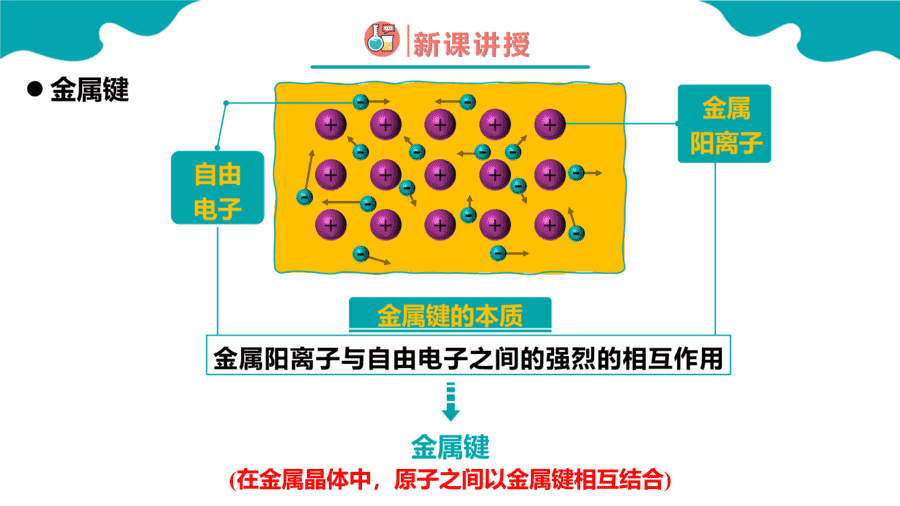
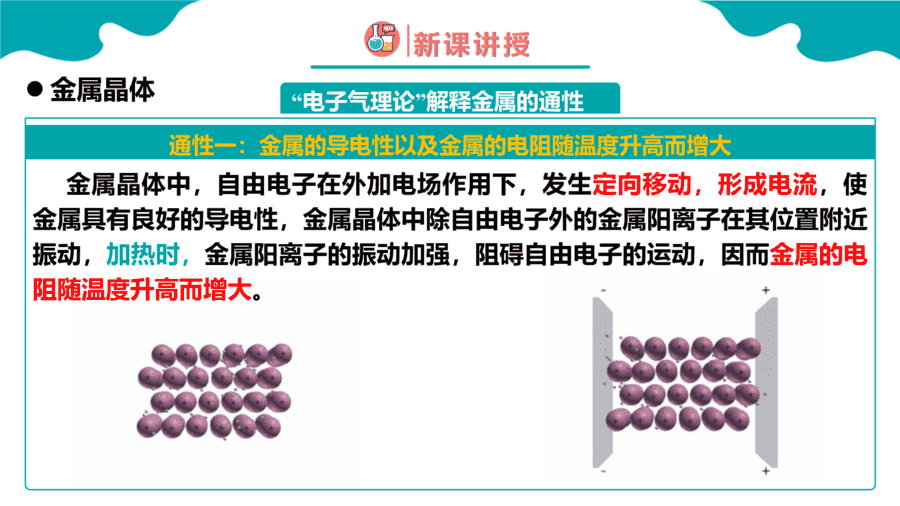
1.下列变化需克服共价键的是
A.金刚石熔化 B.汞变成汞蒸气 C.碘升华 D.食盐溶于水
【答案】A
【详解】A.金刚石为共价晶体,只存在共价键,熔化时克服共价键,故A选;
B.汞受热变成汞蒸气,克服金属键,故B不选;
C.碘单质为分子晶体,碘升华不破坏化学键,克服分子间作用力,故C不选;
D.食盐为离子晶体,溶于水发生电离,克服离子键,故D不选;
故选:A。
2.三氯化铁的熔点为282℃、沸点为315℃,易溶于水,也易溶于乙醚等有机溶剂。在400℃时,它的蒸气中有双聚分子存在。则三氯化铁的晶体类型为
A.分子晶体 B.共价晶体 C.金属晶体 D.离子晶体
【答案】A
【详解】通常晶体熔点高低顺序是:共价晶体>离子晶体>分子晶体;三氯化铁的熔沸点较低,且蒸气中有双聚分子存在,则符合分子晶体特点,故选A。
3.下列叙述不正确的是
A.离子晶体中一定含有阴、阳离子
B.离子晶体都是化合物
C.固态不导电、溶于水能导电,这一性质能说明某晶体一定是离子晶体
D.离子晶体一般具有较高的熔点