(1)分析方法
金属化合物的热重分析研究对象一般为各种金属含氧酸盐、金属氢氧化物、金属氧化物的热分解过程,一般为先失水、再分解、后氧化。
如CoC2O4·2H2O在空气中加热时,受热分解过程分为三个阶段:
第一阶段,失去结晶水生成盐:CoC2O4·2H2O→CoC2O4。
第二阶段,盐受热分解生成氧化物:CoC2O4→CoO。
第三阶段,低价态氧化物与空气中的氧气反应生成高价态氧化物:CoO→Co2O3(或Co3O4)。
注意:
①每个阶段有可能还分为不同步骤,如第一阶段中可能分步失去不同的结晶水,而不是一步失去所有的结晶水。
②如果是变价金属元素,则在空气中加热产物可能为多种价态的金属氧化物。
(2)基本方法和思路
①设晶体(金属化合物)为1 mol,其质量为m。
②失重一般是先失水,再失非金属氧化物。
③计算每步固体剩余的质量m(余),则固体残留率=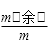 ×100%。
×100%。
④晶体中金属质量不再减少,仍在m(余)中。
⑤失重最后一般为金属氧化物,由质量守恒得m(氧元素),由n(金属)∶n(氧元素),即可求出失重后物质的化学式。
【例题】8.34 g FeSO4·7H2O(M=278 g·mol-1)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,下列说法正确的是( )(双选)
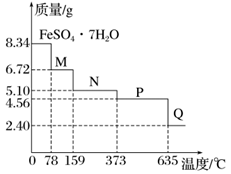
A.温度为78 ℃时,固体M的化学式为FeSO4·5H2O
B.温度为159 ℃时,固体N的化学式为FeSO4·H2O
C.在隔绝空气条件下,由N得到P的化学方程式为FeSO4·H2OFeSO4+H2O
D.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体Q,同时有两种无色气体生成,Q的化学式为Fe3O4
【答案】BC
【解析】8.34 g FeSO4·7H2O样品的物质的量为0.03 mol,其中m(H2O)=0.03 mol×7×18 g·mol-1=3.78 g,如晶体全部失去结晶水,固体的质量应为8.34 g-3.78 g=4.56 g,可知在加热到373 ℃之前,晶体失去部分结晶水,加热至635 ℃时,固体的质量为2.40 g,应为铁的氧化物,其中n(Fe)=n(FeSO4·7H2O)=0.03 mol,m(Fe)=0.03 mol×56 g·mol-1=1.68 g,则固体中m(O)=2.40 g-1.68 g=0.72 g,n(O)=0.045 mol ,则n(Fe)∶n(O)=0.03 mol∶0.045 mol =2∶3,则固体Q的化学式为Fe2O3。温度为78 ℃时,固体质量为6.72 g,其中m(FeSO4)=0.03 mol ×152 g·mol-1=4.56 g,m(H2O)=6.72 g-4.56 g=2.16 g,n(H2O)=0.12 mol,则n(H2O)∶n(FeSO4)=0.12 mol ∶0.03 mol =4∶1,则化学式为FeSO4·4H2O,故A错误;温度为159 ℃时,固体质量为5.10 g,其中m(H2O)=5.10 g-4.56 g=0.54 g,n(H2O)=0.03 mol,则n(H2O)∶n(FeSO4)=0.03 mol∶0.03 mol=1∶1,则化学式为FeSO4·H2O,故B正确;N的化学式为FeSO4·H2O,P的化学式为FeSO4,在隔绝空气条件下由N得到P的化学方程式为FeSO4·H2OFeSO4+H2O,故C正确;P的化学式为FeSO4,Q的化学式为Fe2O3,铁的化合价升高,必有硫的化合价降低,即有二氧化硫生成,根据原子守恒,必有SO3生成,故D错误。
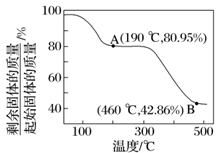
【例题】将草酸锌晶体(ZnC2O4·2H2O)加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,300~460 ℃范围内,发生反应的化学方程式为______________________
【答案】ZnC2O4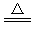 ZnO+CO↑+CO2↑
ZnO+CO↑+CO2↑
【解析】
ZnC2O4·2H2O晶体中的ZnC2O4的质量分数为×100%≈80.95%,故A点完全失去结晶水,化学式为ZnC2O4,假设B点为ZnO,则残留固体占有的质量分数为×100%≈42.86%,故B点残留固体为ZnO,结合原子守恒可知还生成等物质的量的CO与CO2。300 ~460 ℃范围内,发生反应的化学方程式为ZnC2O4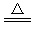 ZnO+CO↑+CO2↑。
ZnO+CO↑+CO2↑。