
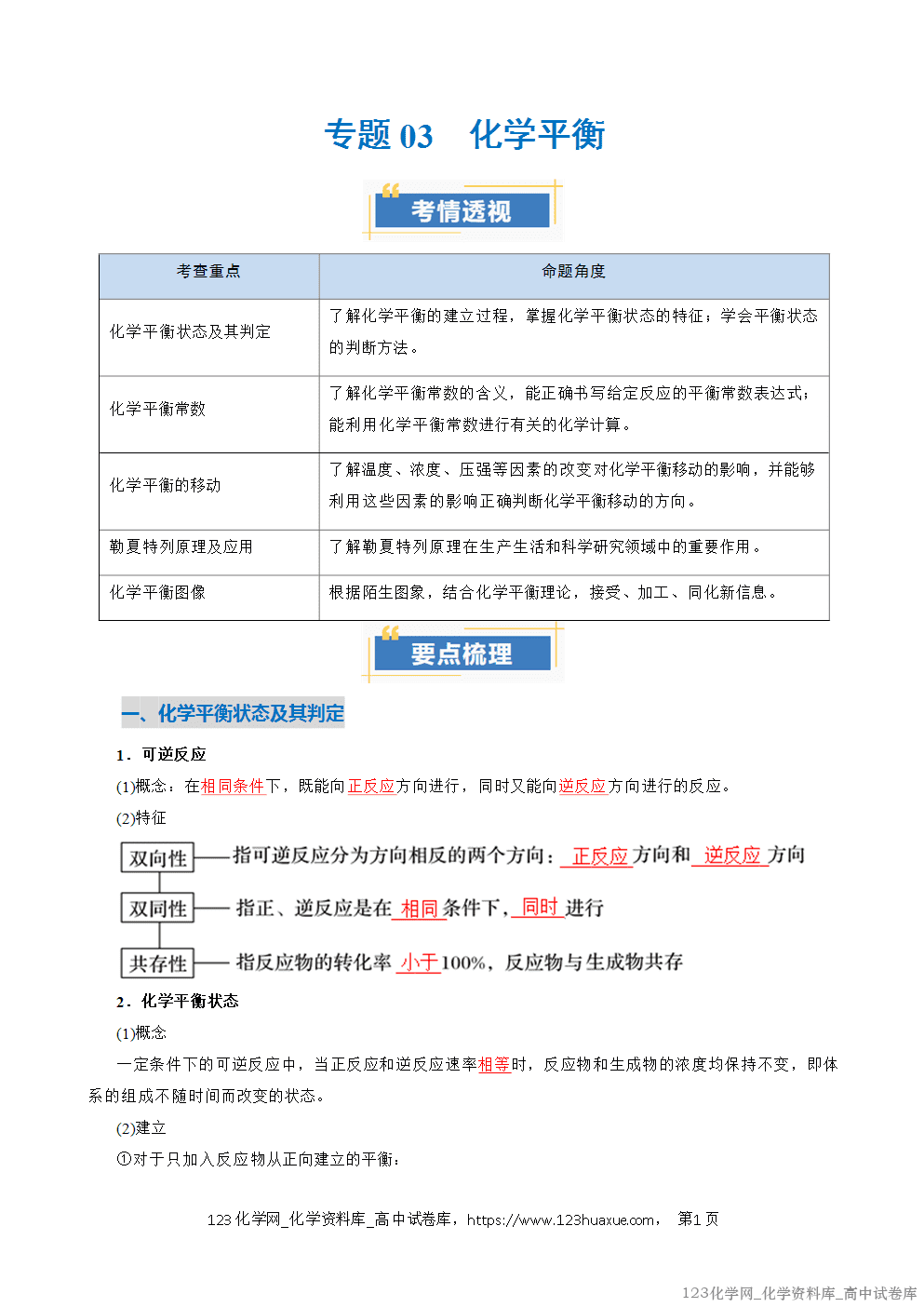







化学平衡常数
1.定义
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,即化学平衡常数,用符号K表示。
2.表达式
对于一般的可逆反应mA(g)+nB(g)pC(g)+qD(g),当在一定温度下达到平衡时,K=()()()()cmA·cnB(cpC·cqD)(固体和纯液体的浓度视为常数,通常不计入化学平衡常数表达式中)。
由于化学方程式的书写不同,平衡常数的表达式不同,如N2+3H22NH3,K=a
则有:2NH3N2+3H2,K′=a(1);2(1)N2+2(3)H2NH3,K″=。
3.影响因素
K只受温度影响,与反应物或生成物的浓度变化无关,与压强变化、是否使用催化剂无关。
4.平衡常数意义及应用
(1)判断可逆反应进行的程度。平衡常数的大小反映化学反应可能进行的程度;平衡常数的数值越大,说明正反应进行的程度越大。
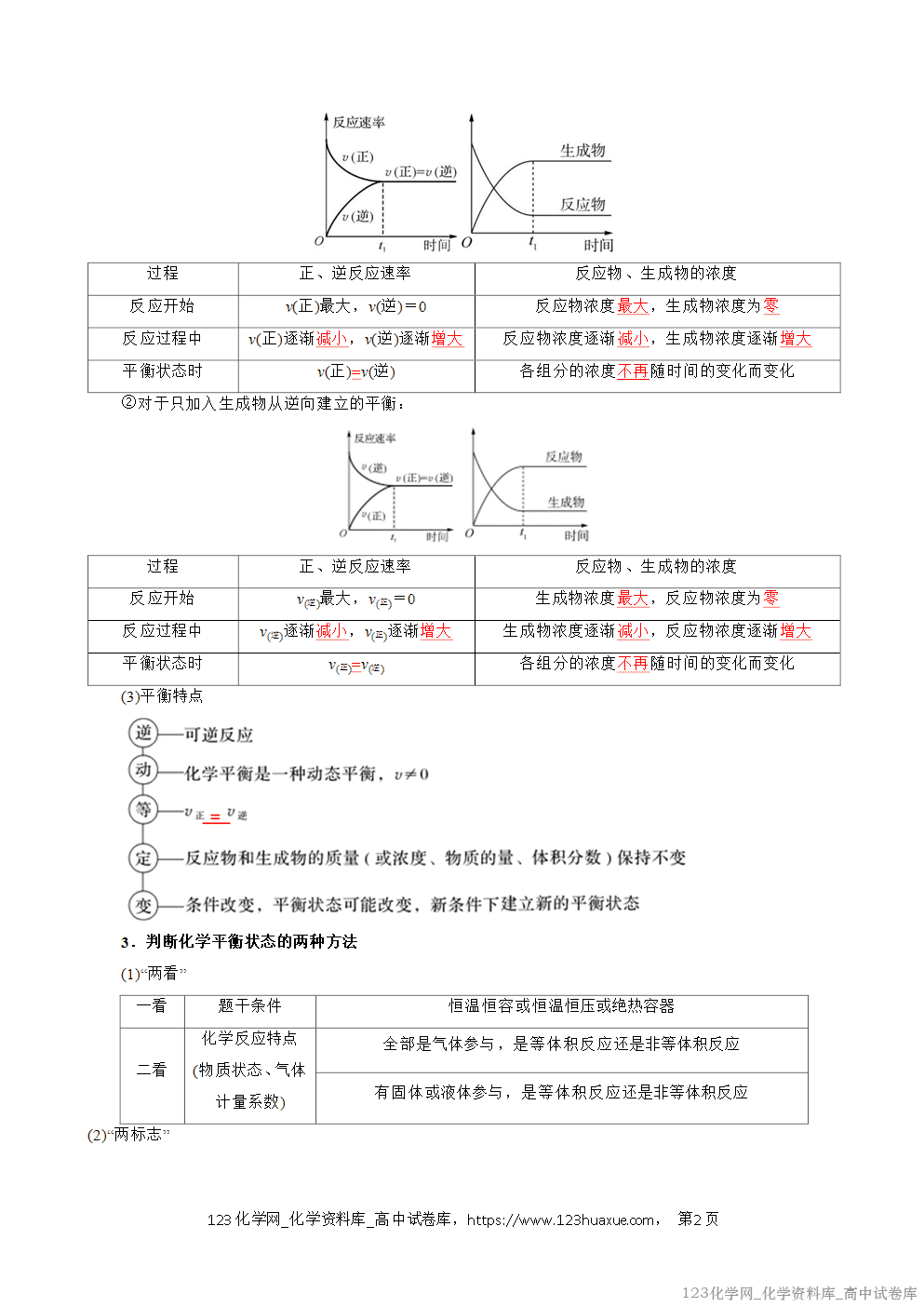
K
<10-5
10-5~105
>105
反应程度
很难进行
反应可逆
反应接近完全
(2)判断反应是否达到平衡或进行的方向
对于化学反应aA(g)+bB(g)cC(g)+dD(g)的任意状态,浓度商:Q=()()()()caA·cbB(ccC·cdD)。
Q<K,反应向正反应方向进行;
Q=K,反应处于平衡状态;
Q>K,反应向逆反应方向进行。