



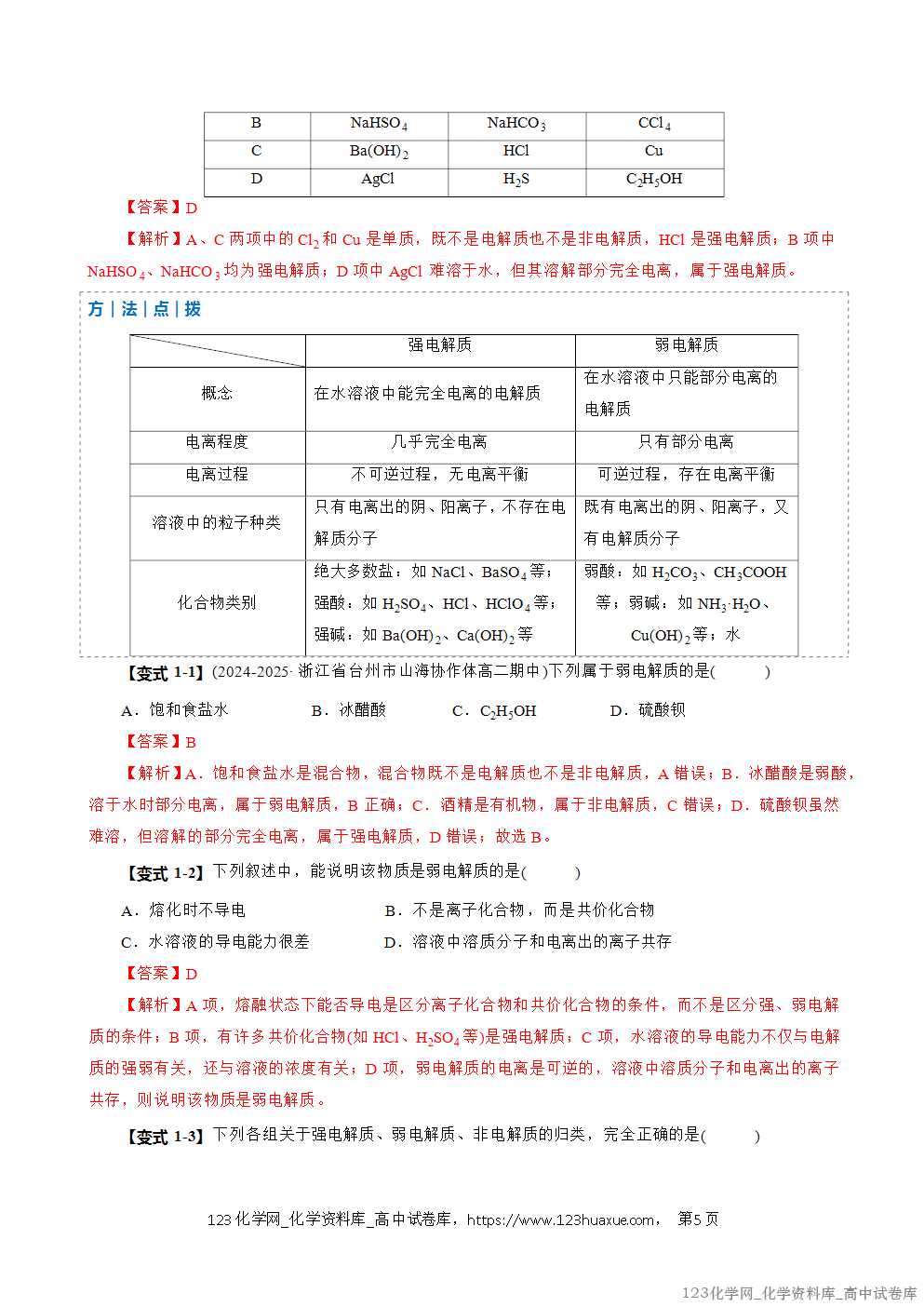




电离平衡常数的应用
(1)根据电离平衡常数可以判断弱酸(或弱碱)的相对强弱,相同条件下,电离平衡常数越大,酸性(或碱性越强。
(2)根据浓度商Q与电离平衡常数K的相对大小判断电离平衡的移动方向。
(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律,如25 ℃时,Ka(HCOOH)=1.77×10-4 mol·L-1,Ka(HCN)=4.9×10-10 mol·L-1,故知HCOOH+NaCN===HCN+HCOONa。
(4)根据电离平衡常数判断溶液中微粒浓度比值的变化情况。
如0.1 mol·L-1 CH3COOH溶液加水稀释,==,加水稀释时,c(H+)减小,Ka值不变,则增大。
6.电离度
(1)概念
在一定条件下的弱电解质达到电离平衡时,已经电离的电解质分子数占原电解质分子总数的百分比。
(2)表示方法
α=溶液中原有弱电解质的分子总数(已电离的弱电解质分子数)×100%,也可表示为α=弱电解质的初始浓度(弱电解质的某离子浓度)×100%。
(3)影响因素
①相同温度下,同一弱电解质,浓度越大,其电离度(α)越小。
②相同浓度下,同一弱电解质,温度越高,其电离度(α)越大。