
提示:多个视频只播放第一个文件,完整视频请下载后播放。
以下展示说课稿部分内容,完整说课稿和课件请下载后参考使用。

教学重点和难点:
教学重点:配位键和配位化合物组成、表示、形成条件及配合物结构和性质
教学难点:配合物形成条件,结构与性质关系
教学过程:
上课!
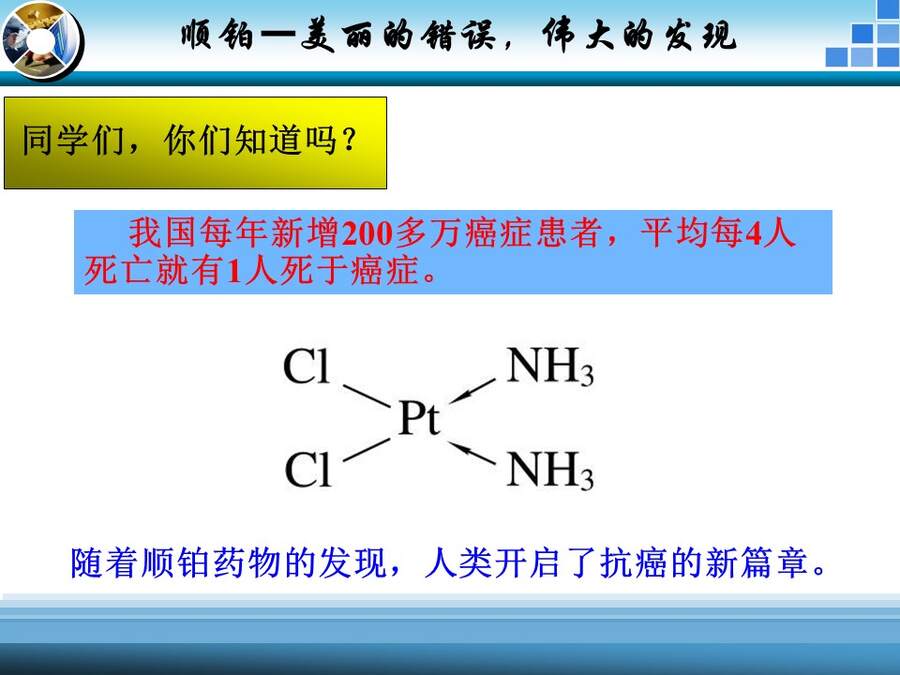
同学们,你们知道吗?我国每年新增200多万癌症患者,平均每4人死亡就有1人死于癌症。但随着顺铂药物的发现,人类开启了抗癌的新篇章。
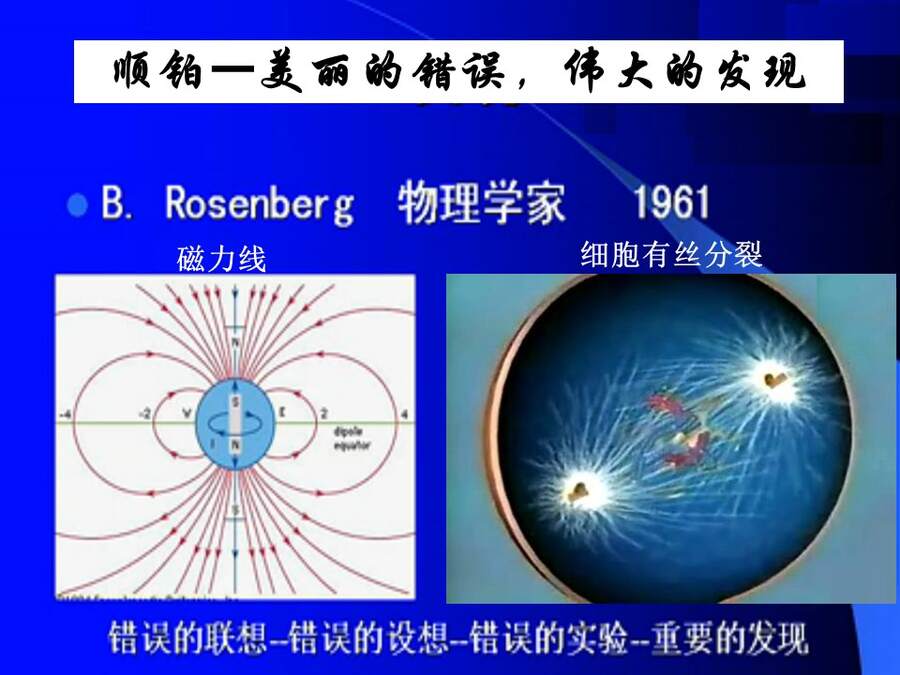
故事:顺铂早在1845年就由意大利化学家合成了,但没有人知道它的作用,所以一直默默无闻。直到1960年,美国的物理学家罗森博格教授,被安排担任了生物系主任,当他通过显微镜看到细胞的有丝分裂时,做为物理学家的罗森博格,脑海中哪里有什么细胞分裂?有的只是物理学中的磁力线,他错误的把这两个完全不相干的事情联系起来,并错误的付诸行动。罗森博格等人用铂做电极,氯化铵做电解质溶液,在测量电流对细菌生长的影响时,却突然发现在铂电极附近,细胞的分裂被抑制了,他们及时发现了这个异常,并调转了研究方向,最终发现这种效应不是电流引起的,而是与铂电极表面产生的化合物有关,这种化合物就是顺铂。后来证实这种抑制对癌细胞有特效!
错误的联想—错误的设想—错误的实验—成就了一个伟大的发现!
顺铂这一“抗癌药里的青霉素”,不但极大的促进了抗癌药物的研发,也由于它是简单的配位化合物,从而大大促进了配位化学的发展。
今天,就让我们一起走进配合物的神秘世界。
一、认识配合物
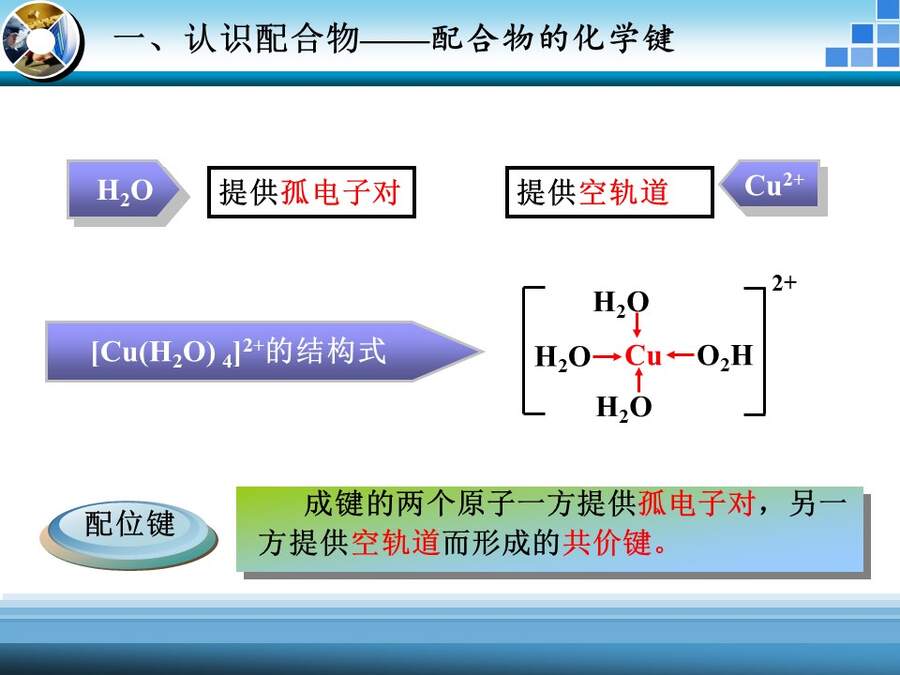
【引入】其实,配合物距离我们并不遥远,白色的硫酸铜粉末溶于水后,溶液变蓝了,原来是因为水分子中的氧原子上有孤电子对,铜离子有空轨道,他们结合在一起形成了[Cu(H2O)4]2+,这种离子是蓝色的,所以溶液变蓝了。
【结论】:我们把成键的两个原子一方(A)提供孤电子对,一方(B)提供空轨道而形成的共价键,称为配位键,表示为A→B。
【教师实验(视频)】:我们身边的配合物还有很多,下面我们再做一个试验。往CuSO4溶液中,逐滴加入浓氨水,先产生蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色溶液。这又是一种配合物——硫酸四氨合铜。
【教师】: 将深蓝色溶液分为两份,一份滴加NaOH溶液, 试管中没有现象,这说明了什么呢?
【学生】:溶液中Cu2+几乎没有了。
【教师】:第二份中滴加BaCl2溶液,试管中有白色沉淀生成,这又说明了什么呢?
【学生】:不错,溶液中有大量SO42-存在。
【思考】:(那么)Cu2+去哪里了呢?(分析结构,可以看出)
这就和做生意一样,Cu2+提供空轨道,NH3提供孤电子对,你情我愿的生意就做成了,形成了[Cu(NH3)4]2+。
【教师】:像硫酸四氨合铜这样由配位键形成的化合物称为配位化合物,简称配合物,它由内界配离子和外界组成,而内界配离子又由中心离子、配体和配位数三部分组成,从刚才的实验来看,内界配离子和外界之间是离子键,容易电离。
內界[Cu(NH3)4]2+中铜离子和氨分子之间真的就不能电离吗?带着这个问题我们进一步探究配合物中的化学平衡。
二、配合物中的化学平衡——铜离子与氯离子的配合
氯离子也有孤电子对,它是不是也能与铜离子形成配离子呢?
【实验】取棕黄色的氯化铜于试管中,向试管中加少量水,生成绿色溶液,继续加水,又生成蓝色溶液。
【思考】棕黄色的氯化铜溶于水为什么不是棕黄色,为什么水量不同,颜色不同呢?(提示[CuCl4]2-配离子的颜色为棕黄色)
【学生猜想】:(同学们的猜想很正确)在溶液中可能存在着两种配离子,如果溶液较浓,则主要显示四氯合铜配离子的棕黄色,如果水多,则主要显示四水合铜配离子的蓝色,如果介于二者之间,就呈现绿色。
【教师】Cl-和Cu2+反应生成配离子[CuCl4]2-如果能与[Cu(H2O)4]2+转化,就说明溶液中存在一个化学平衡:Cu2+ + 4Cl- [CuCl4]2-。
【实验】:向蓝色的氯化铜溶液中加NaCl固体,会有变化吗?溶液由蓝色变为绿色,加水溶液变为蓝色。
【教师】:这是为什么呢?
【结论】:说明加大Cl-浓度能生成更多的[CuCl4]2-,使溶液从蓝色变为绿色(从而证明确实存在一个平衡:Cu2+ + 4Cl- [CuCl4]2-)。
【教师】:化学平衡除了受浓度的影响,还与温度有关。如果改变蓝色氯化铜溶液的温度,会有变化吗?
【实验】:加热蓝色的氯化铜溶液,溶液由蓝色变为绿色,冷却溶液变为蓝色。
【教师】以上这些颜色变化说明了什么呢?
【学生】:(很好,这说明)[Cu(H2O)4]2+、[CuCl4]2-两种配离子确实存在,并且这些配离子是可以相互转化的。
【教师】:(也就是说)内界中心离子和配体之间也能电离,但是微弱的,可逆的。
同时,配位化合物具有一定的稳定性,配位键越强,配合物越稳定,当遇上配合能力更强的配体时,由一种配离子可能会转变成另一种更稳定的配离子。
三、配合物晶体的制备—以[Cu(NH3)4]SO4为例
我们已经认识了配合物,那怎样才能得到配合物晶体呢?我们以前学习过什么方法能把溶液中的溶质提取出来?
【学生】:加热蒸发溶剂,然后冷却结晶
【教师】:是不是可以用这种方法来制备[Cu(NH3)4]SO4晶体呢?请同学们动手验证!
【学生验证实验】:加热蒸发硫酸四氨合铜溶液,闻到刺激性气味,并且看到颜色变黑。
【教师】:这是为什么呢?
【学生】:可能这种物质受热容易分解,不适合加热,生成了氨气和氧化铜
【教师】:那要用什么办法才能得到晶体呢?依据相似相溶原理,溶剂极性不同对溶质溶解能力一般不同。
【实验】:在硫酸四氨合铜溶液中加入乙醇,使溶剂极性降低,析出深蓝色晶体。
【教师】:(现在看来)从溶液中得到晶体的方法应该有两种:
(1)、蒸发溶剂法
(2)、加入乙醇,降低溶剂极性法
四、高考链接,知识升华
【2012 江苏】:一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
【教师】:这是一道江苏的高考题,试着完成第三问!——[Cu(OH)4]2-是怎样产生的呢?请同学们完成自主小实验,并汇报结果。
【自主小实验】:铜离子与氢氧根离子的配合
【学生自主实验】:取两只试管分别加入CuSO4和Al2(SO4)3溶液,再分别持续加入浓NaOH溶液至过量,观察现象,讨论并解释其中原因。
【学生展示】:CuSO4中开始生成氢氧化铜蓝色沉淀,后来蓝色沉淀溶解,是因为生成了[Cu(OH)4]2-;Al2(SO4)3溶液中开始生成氢氧化铝白色沉淀,后来白色沉淀溶解,是因为生成了Na[Al(OH)4]。
【教师】:Cu(OH)2和Al(OH)3都溶解于过量的NaOH,原来都是生成了四羟基配合物。
【提问】:看得出同学们很用心,但是这种解释与高一年级生成NaAlO2的解释是否矛盾呢?
【教师】:随着我们知识的丰富,认识会不断地升华和改写。
五、课堂小结——配合物的应用
配合物在许多领域都有非常广泛的应用,它与我们的生活息息相关,在抗癌药顺铂之后,科学家们还在继续寻找下一代铂系抗癌药,效果较好的是卡铂,这也是一种配合物。希望同学们好好学习化学知识,积极参与化学研究,为人类的发展开辟新的思路。
【板书设计】: