
1.掌握铝及其重要化合物的性质及用途。
2.掌握实验室制取Al(OH)3的方法。
3.掌握可溶性铝盐与强碱溶液反应的计算及图像变化。
4.了解复盐的概念,了解硫酸铝钾[KAl(SO4)2]的性质、俗名及用途。
【知识精讲】
1.铝的性质及用途
(1)存在:铝是地壳中含量最多的金属元素。自然界中的铝全部以化合态存在。
(2)铝的物理性质
银白色、具有金属光泽的固体,熔、沸点高,密度小。质地柔软,具有良好的延展性、导电性、导热性。
(3)铝的化学性质
铝是第三周期ⅢA族元素,容易失电子,是活泼的金属元素。
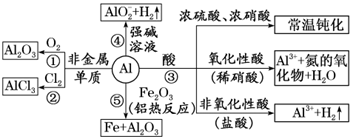
①与非金属单质反应
与O2:4Al+3O2=====点燃2Al2O3(常温下在空气中形成氧化膜)。
【注意要点】铝是活泼金属,但抗腐蚀性能强,原因是常温下Al与O2反应生成一层致密的氧化物薄膜而防止内部金属进一步被氧化。
与Cl2:2Al+3Cl2=====点燃2AlCl3。
③与稀盐酸、稀硫酸等非氧化性酸反应,离子方程式为2Al+6H+===2Al3++3H2↑。
与强氧化性酸(浓硫酸、浓硝酸、稀硝酸)反应:
a.常温下,在浓H2SO4、浓HNO3中发生钝化。
b.与稀硝酸反应:Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O。
④与NaOH等强碱溶液反应:
2Al+2NaOH+2H2O===2NaAlO2+3H2↑或2Al+2OH-+2H2O===2AlO-2+3H2↑。
a.该反应属于置换反应。
b.该反应的实质是:2Al+6H2O===2Al(OH)3+3H2↑、Al(OH)3+NaOH===NaAlO2+2H2O。
c.铝既能与酸(如醋酸、盐酸、稀硫酸等)反应,又能与强碱反应,均能生成H2,表现出两性物质的性质,因此能与Al反应放出H2的溶液可能显酸性也可能显