
电极反应方程式专题专练(精品)
(一)电极反应书写方法
1.电极反应式书写的一般步骤(类似氧化还原反应方程式的书写)
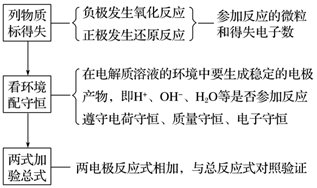
2.已知总方程式,书写电极反应式
(1)书写步骤
①步骤一:写出电池总反应式,标出电子转移的方向和数目(ne-)。
②步骤二:找出正、负极,失电子的电极为负极;确定溶液的酸碱性。
③步骤三:写电极反应式。
负极反应:还原剂-ne-===氧化产物
正极反应:氧化剂+ne-===还原产物
(2)书写技巧
若某电极反应式较难写时,可先写出较易的电极反应式,用总反应式减去较易写的电极反应式,即可得出较难写的电极反应式。如:CH3OCH3(二甲醚)酸性燃料电池中:
总反应式:CH3OCH3+3O2===2CO2+3H2O
正极:3O2+12H++12e-===6H2O
负极:CH3OCH3+3H2O-12e-===2CO2+12H+
特别提醒 简单电极反应中转移的电子数,必须与总方程式中转移的电子数相同。
3.氢氧燃料电池在四种常见介质中的电极反应
负极H2-2e-===2H+ 酸作介质H2-2e-+2OH-===2H2O 碱作介质H2-2e-+O2-===H2O 熔融金属氧化物作介质H2-2e-+CO2-3===H2O+CO2 熔融碳酸盐作介质
正极O2+4e-+4H+===2H2O 酸作介质O2+4e-+2H2O===4OH- 碱作介质O2+4e-===2O2- 熔融金属氧化物作介质O2+4e-+2CO2===2CO2-3 熔融碳酸盐作介质