
存在(HF)n形式,画出(HF)3的链状结构_______。
(4) CF2=CF2和ETFE分子中C的杂化轨道类型分别为_______和_______;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_______。
(5)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______;若该立方晶胞参数为a pm,正负离子的核间距最小为_______pm。
【答案】(1)
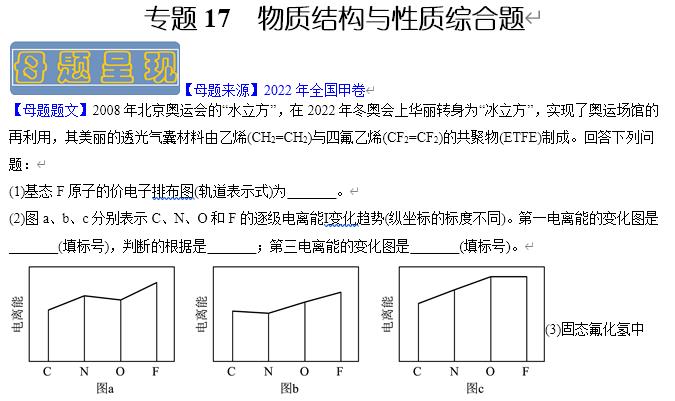
(2) 图a 同一周期第一电离能的总体趋势是依次升高的,但由于N元素的2p能级为半充满状态,因此N元素的第一电离能较C、O两种元素高 图b
(3)
(4) sp2 sp3 C-F键的键能大于聚乙烯中C-H的键能,键能越大,化学性质越稳定(5) Ca2+ a pm
【试题解析】
根据基态原子的电子表示式书写价电子排布式;根据电离能的排布规律分析电离能趋势和原因;根据氢键的表示方法书写(HF)3的结构;根据键能影响物质稳定性的规律分析两种物质的稳定性差异;根据均摊法计算晶胞中各粒子的个数,判断粒子种类。
(1)F为第9号元素其电子排布为1s22s22p5,则其价电子排布图为 ,故答案为 。
(2)C、N、O、F四种元素在同一周期,同一周期第一电离能的总体趋势是依次升高的,但由于N元素的2p能级为半充满状态,因此N元素的第一电离能较C、O两种元素高,因此C、N、O、F四种元素的第一电离能从小到大的顺序为C<O<N<F,满足这一规律的图像为图a,气态基态正2价阳离子失去1个电子生成气态基态正3价阳离子所需要的的能量为该原子的第三电离能,同一周期原子的第三电离能的总体趋势也依次升高,但由于C原子在失去2个电子之后的2s能级为全充满状态,因此其再失去一个电子需要的能量稍高,则满足这一规律的图像为图b,故答案为:图a、同一周期第一电离能的总体趋势是依次升高的,但由于N元素的2p能级为半充满状态,因此N元素的第一电离能较C、O两种元素高、图b。
(3)固体HF中存在氢键,则(HF)3的链状结构为 ,故答案为: 。
(4)CF2=CF2中C原子存在3对共用电子对,其C原子的杂化方式为sp2杂化,但其共聚物ETFE中C原子存在4对共用电子对,其C原子为sp3杂化;由于F元素的电负性较大,因此在与C原子的结合过程中形成的C-F键的键能大于聚乙烯中C-H的键能,键能的强弱决定物质的化学性质,键能越大,化学性质越稳定,因此聚四氟乙烯的化学稳定性高于聚乙烯,故答案为:sp2、sp3、C-F键的键能大于聚乙烯中C-H的键能,键能越大,化学性质越稳定。
(5)根据萤石晶胞结构,浅色X离子分布在晶胞的顶点和面心上,则1个晶胞中浅色X离子共有8× +6× =4个,深色Y离子分布在晶胞内部,则1个晶胞中共有8个深色Y离子,因此该晶胞的化学式应为XY2,结合萤石的化学式可知,X为Ca2+;根据晶胞,将晶胞分成8个相等的小正方体,仔细观察CaF2的晶胞结构不难发现F-位于晶胞中8个小立方体的体心,小立方体边长为 ,体