
1.(无锡模拟)氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的立体构型和中心原子(S)采取杂化方式的说法正确的是( )
A.三角锥形、sp3 B.V形、sp2
C.平面三角形、sp2 D.三角锥形、sp2
2.(盐城模拟)在乙烯分子中有5个σ键、一个π键,它们分别是( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键
D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键
3.经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。从结构角度分析,R中两种阳离子不同之处为( )
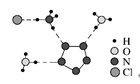
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
4.(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________________________________________。
②氨的沸点________(填“高于”或“低于”)膦(PH3),原因是_________________________
______________________________________________________________________________;
氨是________(填“极性”或“非极性”)分子,中心原子的轨道杂化类型为________。
(2)CS2分子中,C原子的杂化轨道类型是________。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为__________。
(4)已知CO2为直线形结构,SO3为平面正三角形结构,NF3为三角锥形结构,请分别写出