
一、选择题:每小题只有一个选项符合题意。
1.(南宁月考)科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应的热化学方程式为CO(g)+O(g)===CO2(g) ΔH1,反应过程的示意图如下:
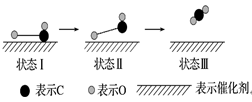
下列说法中正确的是( )
A.ΔH1>0
B.三种状态中,状态Ⅱ最稳定
C.使用催化剂能增大CO和O生成CO2的平衡转化率
D.若2CO(g)+O2(g)===2CO2(g)的反应热为ΔH2,则有ΔH2>2ΔH1
2.下列有关能量的判断和表示方法正确的是( )
A.由C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ·mol-1可知:石墨比金刚石更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C.由H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ
D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ
3.由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
A.反应生成1 mol N2时转移4 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)===N2(g)+NO2(g)
ΔH=-139 kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
4.根据以下三个热化学方程式:
①2H2S(g)+3O2(g)===2SO2(g)+2H2O(l)
ΔH1=-Q1 kJ·mol-1,
②2H2S(g)+O2(g)===2S(s)+2H2O(l)
ΔH2=-Q2 kJ·mol-1,
③2H2S(g)+O2(g)===2S(s)+2H2O(g)
ΔH3=-Q3 kJ·mol-1。
判断Q1、Q2、Q3三者关系正确的是(Q1、Q2、Q3均大于0)( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2
C.Q3>Q2>Q1 D.Q2>Q1>Q3
5.臭氧层中臭氧分解过程如图所示,下列说法正确的是( )
A.催化反应①②均为放热反应
B.催化剂不能改变该反应的焓变
C.ClO是该反应的催化剂
D.在该反应过程中没有化学键的断裂与生成