一、选择题:每小题只有一个选项符合题意。
1.反应2X(g) 2Y(g)+Z(g) ΔH=Q kJ·mol-1(Q>0),达到平衡时,要使正反应速率降低,X的浓度增大,应采取的措施是( )
A.缩小体积加压 B.扩大体积减压
C.增加Z的浓度 D.降温
2.(郑州模拟)一定量混合气体在一体积可变的密闭容器中发生反应:xA(g)+yB(g) zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1。在恒温下将密闭容器的体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是( )
A.平衡向正反应方向移动 B.x+y<z
C.C的体积分数降低 D.B的转化率升高
3.(武汉调研)如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+2Y(g) xZ(g),向M、N中各通入1 mol X和2 mol Y的混合气体,初始时M、N的容积相同,保持温度不变。下列说法正确的是( )
A.若x=3,达到平衡后X的体积分数关系:φ(M)>φ(N)
B.若x<3,Z的平衡浓度关系:c(M)<c(N)
C.若x>3,达到平衡后Y的转化率:α(M)>α(N)
D.x不论何值,平衡时M、N中的平均相对分子质量都相等
4.[2018·全国卷Ⅱ,27(1)改编]CH4—CO2催化重整反应为CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是( )
A.高温低压 B.低温高压
C.高温高压 D.低温低压
二、选择题:每小题有一个或两个选项符合题意。
5.在一固定体积的密闭容器中,进行化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ 700 800 830 1 000 1 200
K 0.6 0.9 1.0 1.7 2.6
则下列有关的叙述正确的是( )
A.该反应为吸热反应
B.可测量容器总压变化来判定化学反应是否达到平衡
C.若在某平衡状态时,c(CO2)×c(H2)=c(CO)×c(H2O),此时的温度为830 ℃
D.达平衡时,浓度:c(CO2)=c(CO)
6.一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g) pC(g),达到平衡时,维持温度不变,将气体体积缩小到原来的12,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
A.m+n>p B.m+n<p
C.平衡向正反应方向移动 D.C的质量分数增加
三、非选择题
7.运用化学反应原理研究化学反应有重要意义。
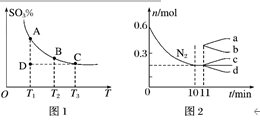
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。