已知某温度时,Na2CO3溶液的水解平衡常数Kh=2×10-4 mol·L-1,则当溶液中c(HCO-3)∶c(CO2-3)=2∶1时,试求该溶液的pH=________。
【答案】10
【解析】
Kh=c(HCO-3)·c(OH-)c(CO2-3)=2×10-4,又c(HCO-3)∶c(CO2-3)=2∶1,则c(OH-)=10-4 mol·L-1,结合Kw=1.0×10-14,可得c(H+)=10-10 mol·L-1。
【提分秘籍】
强碱弱酸盐:
如:CH3COONa溶液:CH3COO-+H2O CH3COOH+OH-
Kh=cCH3COOH·cOH-cCH3COO-
=cCH3COOH·cOH-·cH+cCH3COO-·cH+
=cOH-·cH+cCH3COO-·cH+cCH3COOH=KwKa
其中:Kh为水解平衡常数、Ka(Kb)为弱酸(或弱碱)的电离平衡常数、Kw为水的离子积常数。
【变式演练】
常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡________(填“向左”“向右”或“不”)移动。试计算所得溶液中c(SO2-3)c(HSO-3)=__________________。(常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)
【答案】向右 60
【解析】
NaOH电离出的OH-抑制水的电离平衡,Na2SO3电离出的SO2-3水解促进水的电离平衡。SO2-3+H2O HSO-3+OH-
Kh=c(HSO-3)·c(OH-)c(SO2-3)=KwKa2=10-146.0×10-8
所以c(SO2-3)c(HSO-3)=10-510-146.0×10-8=60。
【题型二】 强酸弱碱盐的水解常数与电离常数的关系
【典例分析】
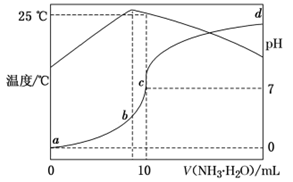
在某温度时,将 氨水滴入 盐酸中,溶液pH与温度随氨水体积变化的曲线如图所示,下列说法错误的是