1.用沉淀滴定法快速测定NaI等碘化物溶液中[I-],实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.246 8 g (0.025 0 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L-1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作为指示剂。
d.用0.100 0 mol·L-1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 1 2 3
消耗NH4SCN标准溶液体积/mL 10.24 10.02 9.98
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有 。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是 。
(3)滴定应在pH<0.5的条件下进行,其原因是 。
(4)b和c两步操作是否可以颠倒? ,说明理由: 。
(5)所消耗的NH4SCN标准溶液的平均体积为 mL,测得[I-]= mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为 。
(7)判断下列操作对[I-]测定结果的影响(填“偏高”“偏低”或“无影响”)。
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果 。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果 。
【答案】 (1)250 mL(棕色)容量瓶、胶头滴管
(2)AgNO3见光易分解
(3)防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解)
(4)否(或不能) 若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点
(5)10.00 0.060 0
(6)用NH4SCN标准溶液进行润洗
(7)①偏高 ②偏高
【解析】 (1)配制溶液所用的玻璃仪器有250mL(棕色)容量瓶、烧杯、玻璃棒、胶头滴管。
(2)AgNO3受热或光照易分解,故存放在棕色试剂瓶中。
(3)Fe3+易水解,若pH过大,会促进Fe3+水解,影响终点的判断。
(4)NH4Fe(SO4)2中Fe3+有氧化性,可以将I-氧化,本身被还原为Fe2+,失去指示剂的作用,同时会影响AgNO3溶液的用量。
(5)第一次实验数据与第二、三次实验数据相差过大,不能使用。取第二、三次实验数据的平均值,所消耗NH4SCN标准溶液的平均体积为10.00mL。[I-]=
(0"." 1000×"(" 25"." 00"-" 10"." 00")" )/(25"." 00)mol·L-1=0.0600mol·L-1。
(6)滴定管使用前要水洗、润洗。润洗是为了防止滴定管内残留的水将滴定管内所装溶液稀释。
(7)[I-]=("[" AgNO_3 "]·" V"(" AgNO_3 ")-[" NH_4 SCN"]·" V"(" NH_4 SCN")" )/V"(待测液)" ,
①使配制AgNO3标准溶液的实际浓度偏小,则消耗NH4SCN溶液的体积偏小,V(NH4SCN)偏小,结果偏高;②俯视读数会使V(NH4SCN)偏小,结果偏高。
【提分秘籍】
(1)定义:沉淀滴定是利用沉淀反应进行滴定、测量分析的方法,生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-的浓度。
(2)原理:沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液测定溶液中Cl-的含量时常以CrO_4^2"-" 为指示剂,这是因为AgCl比Ag2CrO4更难溶的缘故。
【变式演练】
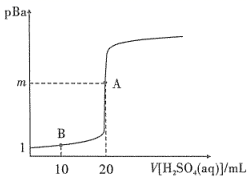
1.已知 时, 。用 的 溶液滴定 溶液,滴定过程中 随硫酸溶液体积的变化如图所示。下列说法正确的是