
第2节 反应热的计算
1.我国长征系列运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)===H2(l) ΔH1=-0.92 kJ·mol-1
(2)O2(g)===O2(l) ΔH2=-6.84 kJ·mol-1
(3)如图:
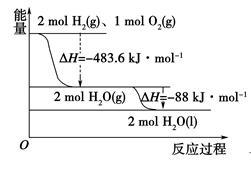
下列说法正确的是 ( C )
A.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
B.氢气的燃烧热为ΔH=-241.8 kJ·mol-1
C.液氢燃烧的热化学方程式2H2(l)+O2(l)===2H2O(g)
ΔH=-474.92 kJ·mol-1
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
解析:由图像分析,2 mol H2(g)与1 molO2(g)反应生成2 mol H2O(g),放出483.6 kJ的热量,故2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量高,A错误;氢气的燃烧热是指1 mol氢气完全燃烧生成液态水放出的热量,故氢气的燃烧热为=285.8 kJ·mol-1,B错误;由图像分析,2H2(g)+O2(g)===2H2O(g) ΔH1=-483.6 kJ·mol-1①,H2(g)===H2(l)
ΔH1=-0.92 kJ·mol-1②,O2(g)===O2(l) ΔH2=-6.84 kJ·mol-1③,将①-②×2-③可得2H2(l)+O2(l)===2H2O(g) ΔH=-474.92 kJ·mol-1,故C正确;H2O(g)生成H2O(l)为物理变化,不存在化学键的断裂和生成,故D错误。
2.下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。