
题型25 新情境下含铁物质的应用
1. (2021·河北,1)“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是( )
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
答案 C
解析 钢是含碳量低的铁合金,故A正确;钢的硬度和脆性与含碳量有关,随着含碳量的增大而增大,故B正确;由题意可知,生铁熔化灌入熟铁,再锻打成钢,说明生铁的熔点低于熟铁,故C错误;赤铁矿的主要成分是Fe2O3,可用于冶炼铁,故D正确。
2.高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
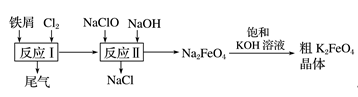
下列叙述错误的是( )
A.用K2FeO4作水处理剂时,既能杀菌消毒又能净化水
B.反应Ⅰ中尾气可用FeCl2溶液吸收再利用
C.反应Ⅱ中氧化剂与还原剂的物质的量之比为3∶2
D.该条件下,物质的溶解性:Na2FeO4<K2FeO4
答案 D
解析 K2FeO4具有强氧化性,可用于杀菌消毒,还原产物为Fe3+,Fe3+水解生成具有吸附性的氢氧化铁胶体,可达到净水的目的,A不符合题意;反应Ⅰ中尾气为Cl2,可与FeCl2继续反应生成FeCl3,B不符合题意;反应Ⅱ中的化学方程式为3NaClO+10NaOH+2FeCl3===2Na2FeO4+9NaCl+5H2O,氧化剂是NaClO,还原剂是FeCl3,所以反应中氧化剂与还原剂的物质的量之比为3∶2,C不符合题意;向饱和的KOH溶液中加入Na2FeO4,K2FeO4晶体析出,说明该条件下,物质的溶解性:Na2FeO4>K2FeO4,D符合题意。