
微题型26 铜及其化合物性质、制备与实验探究
1.(2022·广东茂名市高三模拟)后母戊鼎是迄今世界上出土最大、最重的青铜礼器,形制巨大,雄伟庄严,工艺精巧,足以代表高度发达的商代青铜文化。下列有关说法错误的是( )
A.青铜的熔点低于纯铜
B.古代湿法炼铜的原理是置换反应
C.现代电解精炼铜时,粗铜作阳极
D.青铜器表面的铜绿是铜的一种氧化物
答案 D
解析 青铜是合金,形成合金后熔点降低,则青铜的熔点低于纯铜,故A不选;古代湿法炼铜的原理是铁与硫酸铜反应生成硫酸亚铁和铜,是置换反应,故B不选;现代电解精炼铜时,粗铜作阳极失去电子被氧化,故C不选;青铜器表面的铜绿是碱式碳酸铜,是铜的一种碱式盐,故D选。
2.(2022·山东高三一模)碲被誉为现代工业的维生素,主要用于石油裂化的催化剂,还可添加到钢材中增加其延展性等。某工艺从精炼铜的阳极泥(含有Cu2Te、Au、Ag等)中回收碲和贵重金属的流程如图所示:
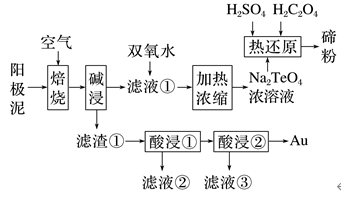
已知:①TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱分别生成Te4+和TeO。
②在1 000 ℃时,Ag才能和O2发生明显的反应,常温下在空气中几乎不反应。
下列说法错误的是( )
A.“焙烧”时,主要反应的化学方程式为Cu2Te+2O22CuO+TeO2
B.“滤液①”中分批加入双氧水,提高H2O2利用率
C.“酸浸①”用稀硫酸浸取,“酸浸②”用稀硝酸浸取
D.“热还原”时,先加H2C2O4,再加足量硫酸,提高反应速率
答案 D
解析 H2O2易分解,向“滤液①”中分批加入双氧水,可以降低H2O2分解率,提高H2O2的利用率,B正确;“滤渣①”主要含有CuO、Ag、Au;“酸浸①”使用H2SO4可以分离出Cu元素,“酸浸②”使用HNO3可以分离出Ag元素,从而将三种金属元素分离,以更好地回收金属,C正确;“热还原”时,发生的化学反应方程式为Na2TeO4+H2SO4+3H2C2O4===Na2SO4+6CO2↑+Te↓+4H2O,由此可知该反应需要强酸性环境,若先加入H2C2O4,再加足量H2SO4,不能提高反应速率,D错误。