
微题型28 CO、CO2的性质、实验探究及应用
1.某学习小组拟利用如图装置探究CO2和锌粉反应是否生成CO,已知CO能与PdCl2溶液发生反应生成黑色金属钯,实验装置如图所示。下列叙述错误的是( )
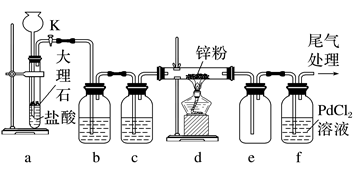
A.实验开始时,先打开活塞K,一段时间后再点燃d处酒精灯
B.装置b、c可以用盛有碱石灰的干燥管替代以达到除去HCl(g)和H2O(g)的目的
C.装置e可以起到防止倒吸的作用
D.装置f中可能发生的反应是CO+PdCl2+H2O===CO2+Pd↓+2HCl
答案 B
解析 CO与空气混合加热会爆炸,因此反应前应先排尽装置内的空气,故实验开始时,先打开活塞K,一段时间后再点燃d处酒精灯,A项正确;二氧化碳和碱石灰反应,故不能用盛有碱石灰的干燥管替代装置b、c,B项错误;CO能与PdCl2溶液发生反应生成黑色金属钯,化学方程式为CO+PdCl2+H2O===CO2+Pd↓+2HCl,D项正确。
2.草酸亚铁晶体受热分解的方程式为FeC2O4·2H2OFeO+CO2↑+CO↑+2H2O,下列说法不正确的是( )
A.将生成的气体通入澄清石灰水中,可能得到无色溶液
B.将生成的气体通过足量的NaOH溶液和灼热的CuO固体,可检验生成的CO
C.分解产物应先检验CO2和CO,再检验H2O
D.通过测量反应前后固体的质量,可推出FeC2O4受热是否完全分解
答案 C
解析 生成的气体中含有CO2,过量的二氧化碳通入石灰水中,可得无色碳酸氢钙溶液,故A正确;生成的气体通过足量的NaOH溶液,CO2被吸收,剩余的CO气体可以还原灼热的CuO,黑色固体变为红色,可以检验一氧化碳气体的生成,故B正确;因检验产物CO2需通过澄清石灰水,从石灰水中出来的气体自带水汽,则应先检验H2O,然后再检验CO2,最后检验CO,故C错误;根据分解的化学方程式,可计算出反应前后固体的质量比,则可通过测量反应前后固体的质量,判断FeC2O4受热是否完全分解,故D正确。