
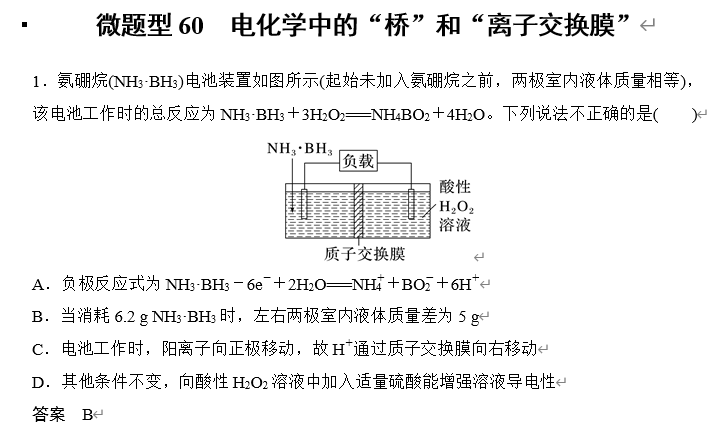
解析 左侧通入NH3·BH3,电极为负极,发生失电子的氧化反应,电极反应式为NH3·BH3+2H2O-6e-===NH+4+BO-2+6H+,A正确;未加入氨硼烷之前,两极室质量相等,消耗6.2 g NH3·BH3后,负极反应式为NH3·BH3+2H2O-6e-===NH+4+BO-2+6H+,正极反应式为3H2O2+6H++6e-===6H2O,则转移电子的物质的量为1.2 mol,则左室质量增加6.2 g-1.2 g=5 g,右室质量增加1.2 g,即两极质量相差(5-1.2) g=3.8 g,B错误;电池内部阳离子向正极移动,右侧H2O2所在电极为正极,电池工作时H+由左侧极室经质子交换膜进入右侧极室,C正确;H2SO4是强电解质,其他条件不变,向酸性H2O2溶液中加入适量硫酸能增大溶液中自由移动离子的浓度,故能增强溶液导电性,D正确。
2.(2022·烟台一模)我国科学家研发了一种水系可逆Zn-CO2电池,将A、B两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH-,工作原理如图所示。下列说法错误的是( )
资料标签: