
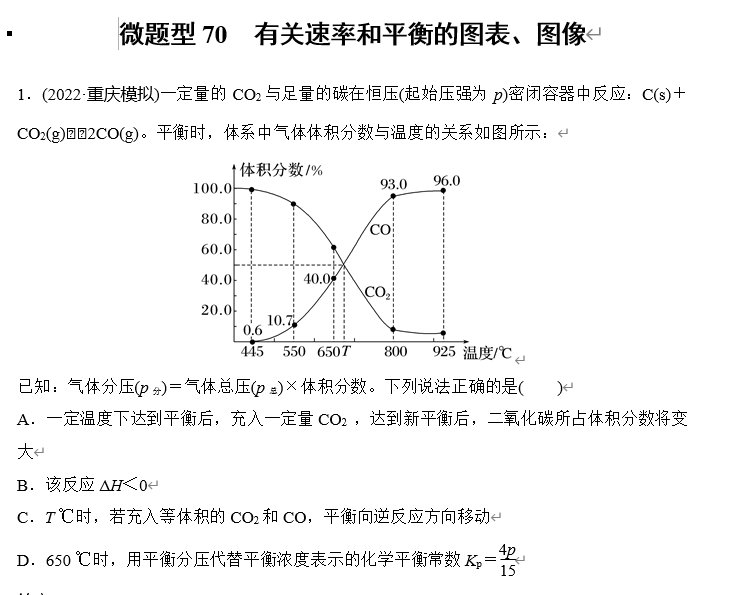
答案 D
解析 一定温度下达到平衡后,由于是恒压容器,充入一定量CO2,利用建模思想得到容器体积变大,达到新平衡后,二氧化碳所占体积分数不变,故A错误;升高温度,二氧化碳体积分数减小,说明平衡正向移动,即正向为吸热反应,故B错误;T ℃时,CO2和CO体积分数相等,若充入等体积的CO2和CO,利用建模思想得到容器体积变大,平衡不移动,故C错误;650 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=p×0.42p×0.6=4p15,故D正确。
2.二甲醚催化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)===CH3COOCH3(g) ΔH1=a kJ·mol-1
反应Ⅱ:CH3COOCH3(g)+2H2(g)===CH3CH2OH(g)+CH3OH(g) ΔH2=b kJ·mol-1
反应Ⅰ、Ⅱ的平衡常数的对数lg K1、lg K2与温度的关系如图1所示;固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图2所示。下列说法正确的是( )
资料标签: