
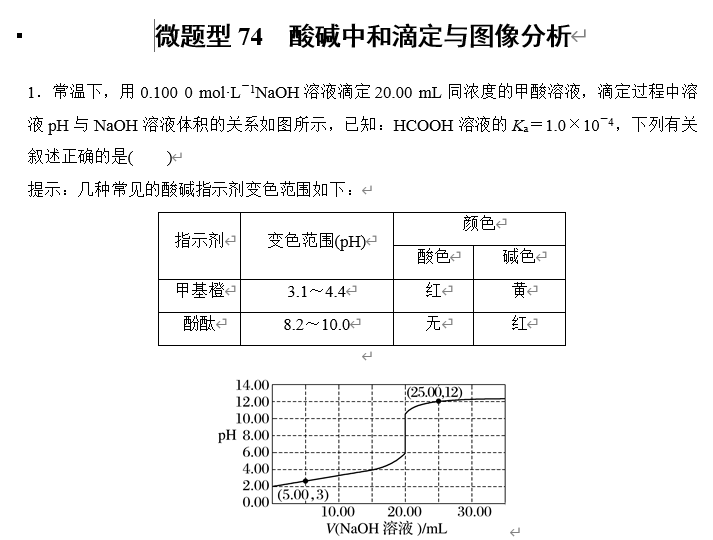
A.当加入10.00 mL NaOH溶液时,溶液中:c(HCOO-)>c(Na+)>c(HCOOH)
B.该滴定过程中选择甲基橙试液作为指示剂
C.当加入20.00 mL NaOH溶液时,溶液pH=7.0
D.加入5.00 mL NaOH溶液和加入25.00 mL NaOH溶液时,水的电离程度相同
答案 A
解析 当加入10.00 mL NaOH溶液时,得到等浓度的甲酸钠、甲酸混合溶液,溶液呈酸性,而甲酸电离程度大于甲酸根离子水解程度,因此c(HCOO-)>c(Na+)>c(HCOOH),A正确;由图可知pH突变范围大约为6.00~11.00,应选用酚酞作指示剂,B错误;当加入20.00 mL NaOH溶液时,反应后溶质为甲酸钠,显碱性,pH >7.0,C错误;根据图像可知,加入5.00 mL NaOH溶液时,氢氧化钠不足,溶液呈酸性,抑制了水的电离,c(H+)水=c(OH-)水=10-11 mol·L-1,加入25.00 mL NaOH溶液时,NaOH过量,溶液呈碱性,抑制了水的电离,c(H+)水=10-12 mol·L-1,两点处水电离出的氢离子浓度不同,则水的电离程度不同,D错误。
2.(2022·河南模拟)用0.100 0 mol·L-1 NaOH溶液分别滴定20 mL 0.100 0 mol·L-1 HCl和HAc(醋酸)的滴定曲线如图所示。下列说法正确的是( )