
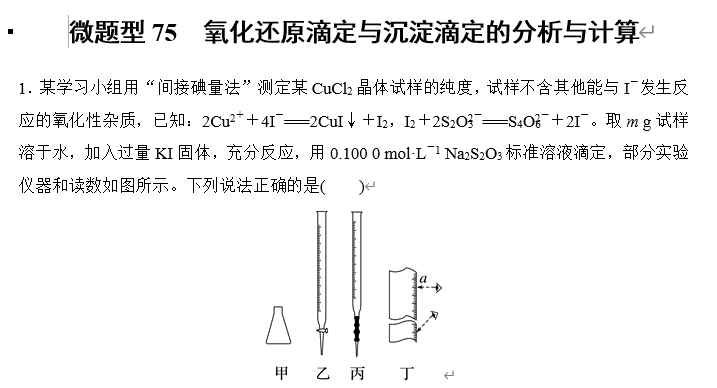
A.试样在容量瓶中溶解,滴定管选乙
B.选用淀粉作指示剂,当甲中溶液由无色变为蓝色时,即达到滴定终点
C.丁图中,滴定前滴定管的读数为(a-0.50) mL
D.对装有待测液的滴定管读数时,滴定前后读数方式如丁图所示,则测得的结果偏大
答案 D
解析 容量瓶不能作为溶解或稀释的仪器,故试样不能直接在容量瓶中溶解,Na2S2O3溶液显碱性,故滴定管选丙,A错误;选用淀粉作指示剂,当甲中溶液由蓝色变为无色,且半分钟内不恢复蓝色时,即达到滴定终点,B错误;滴定管的“0”刻度在上面,越往下刻度越大,故丁图中,滴定前滴定管的读数为(a+0.50) mL,C错误;对装有待测液的滴定管读数时,滴定前后读数方式如丁图所示,则读出的待测液的体积偏小,即实际体积偏大,故测得的结果偏大,D正确。
2.用0.10 mol·L-1NaHSO4滴定50 mL 0.100 mol·L-1Ba(OH)2溶液的滴定曲线如图所示。下列有关描述错误的是( )
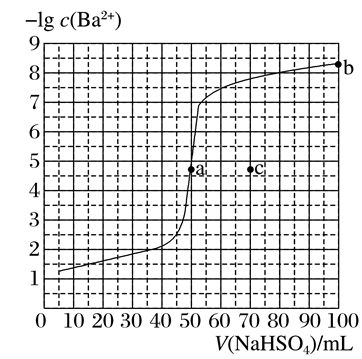
A.根据曲线数据可知Ksp(BaSO4)的数量级为10-10
B.室温下,a点的pH=14
C.b点溶质为Na2SO4
D.相同实验条件下,若改为0.140 mol·L-1Ba(OH)2,滴定反应终点移到c点
答案 B
解析 当BaSO4恰好完全沉淀时消耗的NaHSO4为50 mL,由图可知,此时-lg c(Ba2+)约为4.7,故而c(Ba2+)=10-4.7 mol·L-1=c(SO2-4),Ksp(BaSO4)=10-9.4,数量级为10-10,A正确;室温下,至a点反应的离子方程式为Ba2++OH-+SO2-4+H+===BaSO4↓+H2O,此时溶液显碱性,n(OH-)=50×10-3 L×0.100 mol·L-1=5×10-3 mol,忽略混合后体积的变化可得c(OH-)=5×10-2 mol·L-1,c(H+)=2×10-13 mol·L-1,故而pH≈12.7,B错误;至b点反应的化学方程式为2NaHSO4+ Ba(OH)2===BaSO4↓+2H2O+Na2SO4,故b点的溶质为Na2SO4,C正确;相同实验条件下,若改为0.140 mol·L-1 Ba(OH)2,则BaSO4恰好完全沉淀时消耗的NaHSO4为70 mL,故而滴定反应终点移到c点,D正确。
3.下列与滴定实验有关的说法正确的是( )
A.用碱式滴定管准确量取20.00 mL的高锰酸钾溶液
B.NaOH标准液滴定盐酸,若滴定结束时俯视刻度,会导致测定结果偏高
C.醋酸滴定未知浓度的NaOH溶液时,用甲基橙作指示剂,会导致测定结果偏高
D.用KMnO4滴定亚硫酸钠溶液时,当最后半滴高锰酸钾标准液滴入锥形瓶中,溶液颜色由无色变为粉红色时,即达滴定终点