


1.回忆实验室制取氯气的化学方程式与离子方程式。
2.怎样闻充满在集气瓶中的气体的气味?
3.实验室条件下制备的密度比空气小的气体如何收集? 学#科网
【答案】
【新知精讲】
一、氮的固定
1.定义:使游离态的氮转化为氮的化合物的过程。
2.方法:雷电固氮:N2+O22NO
人工固氮:N2+3H22NH3
生物固氮:豆科植物的根瘤菌吸收N2形成含氮化合物。
二、氨的性质
1.物理性质
颜色
气味
溶解性
沸点
无色
刺激性气味
极易溶于水(常温下,体积比1∶700)
较低,易液化
2.化学性质
(1)还原性:与氧气反应:4NH3+5O24NO+6H2O,
应用:工业制硝酸。
(2)与酸反应:
与氯化氢反应:NH3+HCl===NH4Cl,
现象:产生白烟,
应用:用于NH3和HCl气体的互相检验。
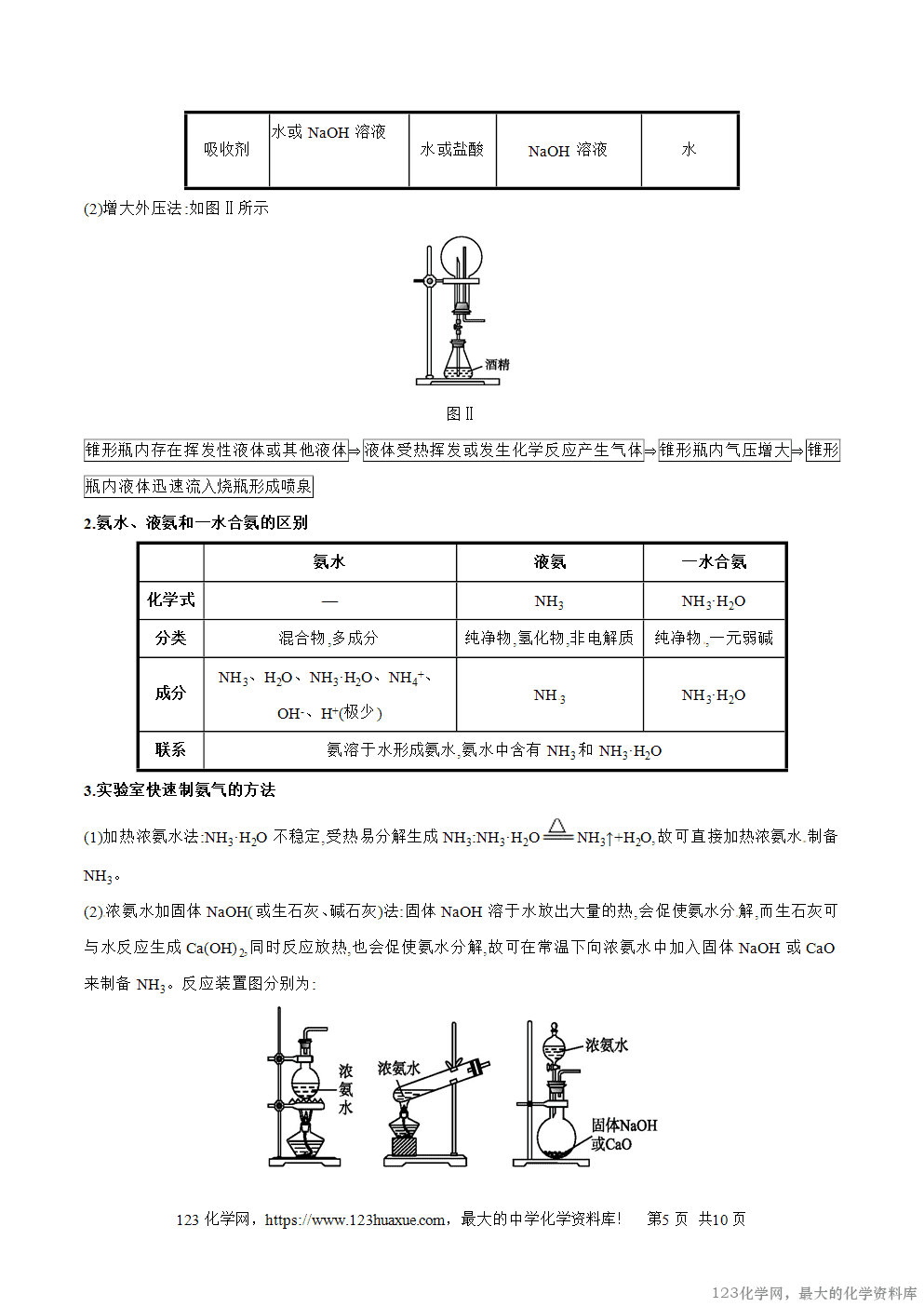
(3)与水反应:NH3+H2ONH3·H2O。
氨的水溶液叫做氨水,呈弱碱性。
3.用途
(1)氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱的原料。
(2)作制冷剂。
三、铵盐
1.铵盐
铵根离子(NH4+)和酸根离子构成的化合物。
2.物理性质
都是无色或白色晶体,易溶于水。
3.化学性质
(1)不稳定性:
①NH4Cl受热分解:NH4ClNH3↑+HCl↑,
现象:白色固体消失,在试管上方重新凝结成白色固体。[来源:学科网]
②NH4HCO3受热分解:NH4HCO3NH3↑+CO2↑+H2O,
现象:白色固体消失,在试管口部有无色液体凝结。
(2)与碱反应:NH4Cl溶液与NaOH溶液共热的化学方程式:NH4Cl+NaOHNaCl+NH3↑+H2O。
4. NH4+的检验
(1)原理NH4++OH-NH3↑+H2O
(2)操作流程: