




练习3 硫及其化合物的转化
1. (2023·泰州中学)硫及其化合物的转化具有重要应用。下列说法错误的是(A)
A. 废水中的Hg2+可以被H2S还原后除去
B. 大气中的SO2遇雨水最终形成H2SO4进入地面或海洋
C. 工业排放尾气中的SO2可与CaO和O2反应生成CaSO4
D. 水垢中的CaSO4可与饱和Na2CO3溶液反应生成CaCO3
【解析】 Hg2+与H2S生成HgS沉淀,该反应是非氧化还原反应,A错误;SO2和水生成H2SO3,H2SO3能被空气中氧气氧化为H2SO4,B正确;O2具有氧化性,能将SO2氧化,SO2可与CaO和O2反应生成CaSO4,C正确;CaSO4溶解度大于CaCO3,CaSO4可与饱和Na2CO3溶液反应生成CaCO3,D正确。
2. (2024·江苏各地模拟重组)下列化学反应表示错误的是(B)
A. H2S与硫酸铜溶液反应:Cu2++H2S===CuS↓+2H+
B. 用Na2SO3溶液还原酸性废液中I2的反应:SO3(2-)+I2===SO4(2-)+2I-
C. 用Fe2O3·H2O脱除天然气中的H2S:Fe2O3·H2O+3H2S===2FeS+S+4H2O
D. 在过硫化钠(Na2S2)中加入稀盐酸,产生淡黄色沉淀和臭鸡蛋气味的气体,发生歧化反应:
Na2S2+2HCl===2NaCl+H2S↑+S↓
【解析】 该反应中原子不守恒、电荷不守恒,B错误。
3. (2023·扬州期初)实验室制取少量H2S并探究其性质。下列实验装置和操作不能达到实验目的的是(B)
甲 乙 丙 丁
A. 用装置甲制备少量H2S
B. 用装置乙探究H2S的漂白性
C. 用装置丙探究H2S的酸性
D. 用装置丁吸收H2S
【解析】 H2S与氯水发生氧化还原反应使氯水褪色,H2S表现还原性,不是漂白性,B错误。
4. (2024·扬州期末)下列指定反应的离子方程式书写正确的是(B)
A. 少量SO2与过量NaOH溶液反应:SO2+OH-===HSO3(-)
B. Na2S2O3溶液与稀硫酸反应:S2O3(2-)+2H+===S↓+SO2↑+H2O
C. Na2S2O3溶液与足量氯水反应:S2O3(2-)+2Cl2+3H2O===2SO3(2-)+4Cl-+6H+
D. Na2S溶液在空气中久置变浑:2Na2S+O2+2H2O===4Na++4OH-+2S↓
【解析】 少量SO2与过量NaOH溶液生成Na2SO3和水,A错误;S2O3(2-)被Cl2氧化为SO4(2-),C错误;Na2S溶于水,书写离子方程式应拆开,D错误。
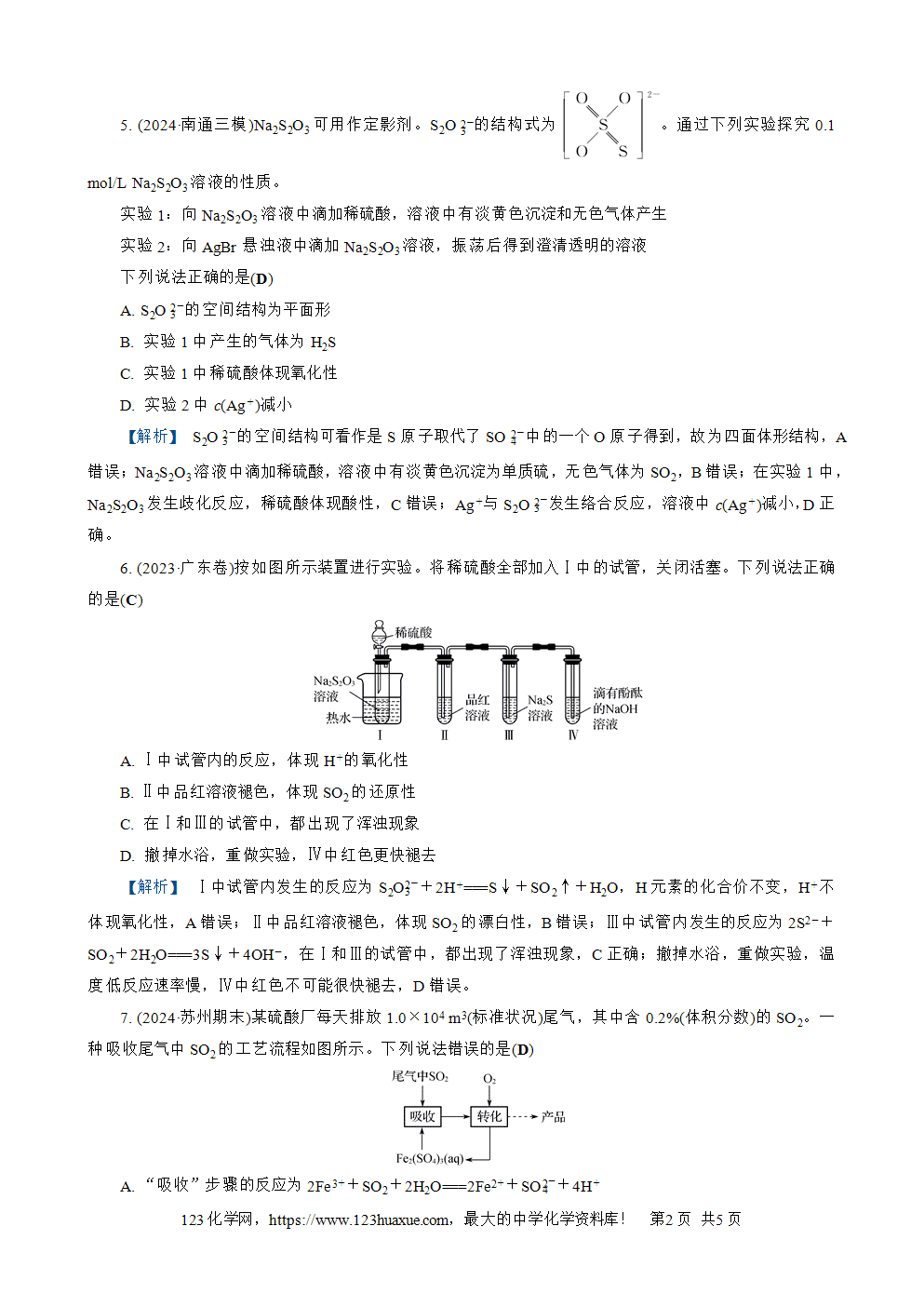
5. (2024·南通三模)Na2S2O3可用作定影剂。S2O3(2-)的结构式为。通过下列实验探究0.1 mol/L Na2S2O3溶液的性质。
实验1:向Na2S2O3溶液中滴加稀硫酸,溶液中有淡黄色沉淀和无色气体产生
实验2:向AgBr悬浊液中滴加Na2S2O3溶液,振荡后得到澄清透明的溶液
下列说法正确的是(D)
A. S2O3(2-)的空间结构为平面形
B. 实验1中产生的气体为H2S
C. 实验1中稀硫酸体现氧化性
D. 实验2中c(Ag+)减小
【解析】 S2O3(2-)的空间结构可看作是S原子取代了SO4(2-)中的一个O原子得到,故为四面体形结构,A错误;Na2S2O3溶液中滴加稀硫酸,溶液中有淡黄色沉淀为单质硫,无色气体为SO2,B错误;在实验1中,Na2S2O3发生歧化反应,稀硫酸体现酸性,C错误;Ag+与S2O3(2-)发生络合反应,溶液中c(Ag+)减小,D正确。
6. (2023·广东卷)按如图所示装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是(C)
A. Ⅰ中试管内的反应,体现H+的氧化性
B. Ⅱ中品红溶液褪色,体现SO2的还原性
C. 在Ⅰ和Ⅲ的试管中,都出现了浑浊现象
D. 撤掉水浴,重做实验,Ⅳ中红色更快褪去
【解析】 Ⅰ中试管内发生的反应为S2O3(2-)+2H+===S↓+SO2↑+H2O,H元素的化合价不变,H+不体现氧化性,A错误;Ⅱ中品红溶液褪色,体现SO2的漂白性,B错误;Ⅲ中试管内发生的反应为2S2-+SO2+2H2O===3S↓+4OH-,在Ⅰ和Ⅲ的试管中,都出现了浑浊现象,C正确;撤掉水浴,重做实验,温度低反应速率慢,Ⅳ中红色不可能很快褪去,D错误。
7. (2024·苏州期末)某硫酸厂每天排放1.0×104 m3(标准状况)尾气,其中含0.2%(体积分数)的SO2。一种吸收尾气中SO2的工艺流程如图所示。下列说法错误的是(D)
A. “吸收”步骤的反应为2Fe3++SO2+2H2O===2Fe2++SO4(2-)+4H+
B. “转化”步骤中氧化剂与还原剂的物质的量之比为1∶4
C. 该工艺可以得到产品H2SO4
D. 该工艺处理尾气,每天至少需要消耗20 m3的O2 (标准状况下)
【解析】 “吸收”步骤SO2将Fe3+还原为Fe2+,SO2被氧化为SO4(2-),A正确;“转化”步骤反应为4Fe2++O2+4H+===4Fe3++2H2O,氧化剂(O2)与还原剂(Fe2+)的物质的量之比为1∶4,B正确;“吸收”步骤的化学方程式为Fe2(SO4)3+SO2+2H2O===2FeSO4+2H2SO4,该工艺可以得到产品H2SO4,C正确;该工艺总反应为2SO2+O2+2H2O===2H2SO4,则每天需要O2的体积为2(1)×1.0×104 m3×0.2%=10 m3,D错误。