




大单元五 化学反应与能量变化
第17讲 反应热 盖斯定律
1. (2024·南航苏州附中)下列说法正确的是(B)
A. 任何放热反应在常温条件下一定能发生反应
B. 生石灰溶于水的过程中有物质变化,也伴随着能量变化
C. 炎热夏季,洒在道路上的水吸热蒸发,该过程是吸热反应
D. 烛光晚餐时,蜡烛燃烧仅产生热能一种能量
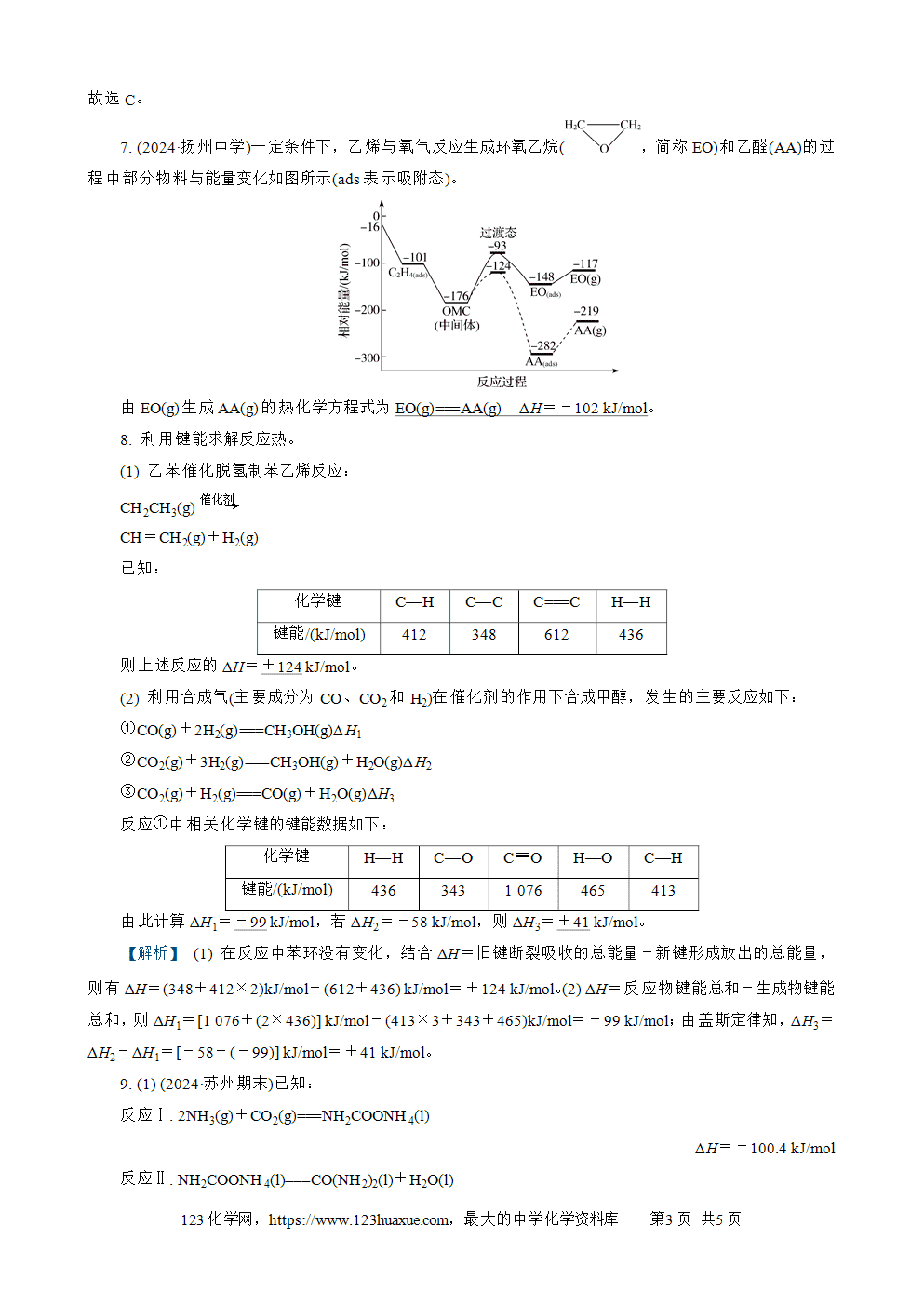
【解析】 放热反应在常温条件下不一定能发生,如铝热反应为放热反应,但常温下不能发生反应,A错误;洒在道路上的水吸热蒸发,该过程是吸热过程,由于没有新物质生成,不是吸热反应,C错误;烛光晚餐时,蜡烛燃烧产生了热能、光能,D错误。
2. (2024·江苏各地模拟)下列说法正确的是(C)
A. 已知甲醇燃烧热为726.51 kJ/mol,则CH3OH燃烧热的热化学方程式:CH3OH(l)+2(3)O2(g)===CO2(g)+2H2O(g)
ΔH=-726.51 kJ/mol
B. 已知锂在氧气中燃烧与Mg相似,其燃烧热为299 kJ/mol。锂燃烧的热化学方程式:2Li(s)+O2(g)===Li2O2(s) ΔH=+299 kJ/mol
C. 反应2H2S(g)+3O2(g)===2SO2(g)+2H2O(g) ΔH<0,说明反应物的键能总和小于生成物的键能总和
D. 已知H2的标准燃烧热是285.8 kJ/mol,其燃烧的热化学方程式可以表示为2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ/mol
【解析】 表示燃烧热的热化学方程式中的产物水应该为液态,A错误;根据锂的燃烧热数值,热化学方程式应表示为Li(s)+4(1)O2(g)===2(1)Li2O ΔH=-299 kJ/mol,B错误;该反应的ΔH<0,ΔH=反应物的键能总和-生成物的键能总和<0,则反应物的键能总和小于生成物的键能总和,C正确;根据H2的标准燃烧热数值,则表示该热化学方程式应为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,D错误。
3. 合成氨反应为N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol。下列有关合成氨反应的说法正确的是(C)
A. 反应的ΔS>0
B. 用E表示键能,该反应的ΔH=E(N—N)+
3E(H—H)-6E(N—H)
C. 反应中每消耗1 mol H2,转移电子的数目约为2×6.02×1023
D. 反应在高温、高压、催化剂条件下进行,可提高H2的平衡转化率
【解析】 合成氨反应是气体分子数减小的反应,ΔS<0,A错误;ΔH=反应物的键能之和-生成物的键能之和=E(N≡N)+3E(H—H)-6E(N—H)(E表示键能),B错误;由关系式:N2~3H2~6e-知,反应中每消耗1 mol H2转移电子的数目约为2×6.02×1023,C正确;该反应是放热反应,升高温度,平衡逆向移动,催化剂只能改变化学反应速率,不能改变平衡转化率,D错误。
4. (2020·江苏卷)反应SiCl4(g)+2H2(g)高温(=====)Si(s)+4HCl(g)可用于纯硅的制备。下列有关该反应的说法正确的是(B)
A. 该反应ΔH>0、ΔS<0
B. 该反应的平衡常数K=()()()cSiCl4·c2H2(c4HCl)
C. 高温下,反应每生成1 mol Si需消耗2×22.4 L H2
D. 用E表示键能,该反应ΔH=4E(Si—Cl)+2E(H—H)-4E(H—Cl)
【解析】 该反应是气体分子数增大的反应,则ΔS>0,A错误;反应每生成1 mol Si需要消耗2 mol H2,高温下气体摩尔体积不为22.4 L/mol,C错误;ΔH=反应物的键能总和-生成物的键能总和,该式子中应再减去2E(Si—Si),D错误。