







第19讲 电解池及其应用
练习1 电解池原理
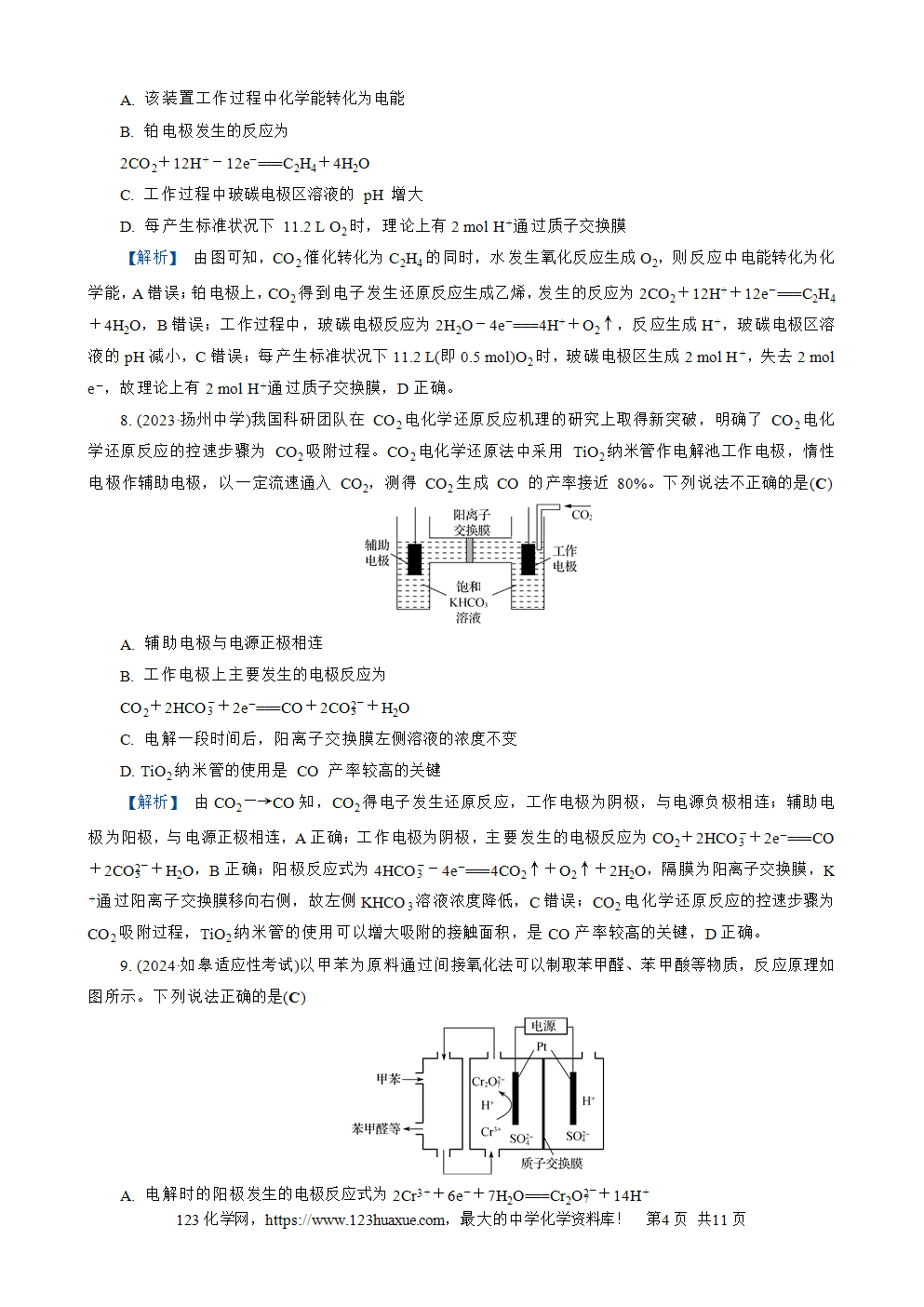
1. (2024·南京二模)一种电解乙酰基吡嗪废水中的(NH4)2SO4制备(NH4)2S2O8的电化学装置如图所示。下列说法正确的是(B)
A. 石墨电极与直流电源正极相连
B. 电解时,铂网电极附近pH增大
C. 离子交换膜应选择性透过阴离子
D. 阴极上的电极反应为2SO4(2-)+2e-===S2O8(2-)
【解析】 由图可知,铂网电极上(NH4)2SO4失去电子发生氧化反应生成(NH4)2S2O8,铂网为阳极,则石墨为阴极,与直流电源负极相连,A错误; 阳极反应式为2SO4(2-)-2e-===S2O8(2-),阴极反应式为2H++2e-===H2↑,则右侧氢离子通过离子交换膜进入左侧,使得铂网电极附近pH增大,B正确;C、D错误。
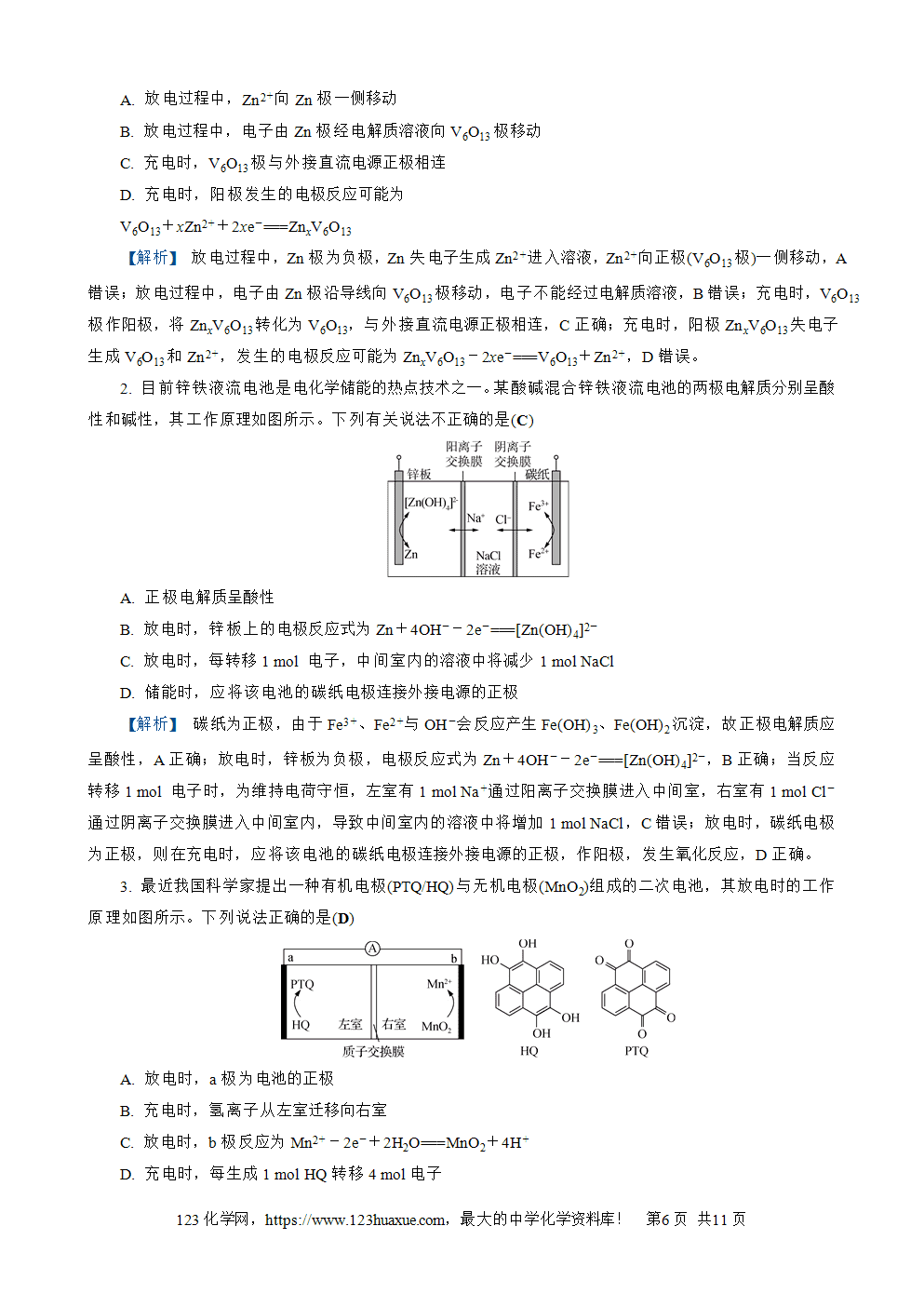
2. (2021·江苏卷)通过下列方法可分别获得H2和O2:①通过电解获得NiOOH和H2(如图所示);②在90 ℃将NiOOH与H2O反应生成Ni(OH)2并获得O2。下列说法正确的是(B)
A. 电解后KOH溶液的物质的量浓度减小
B. 电解时,阳极电极反应式:Ni(OH)2+OH--e-===NiOOH+H2O
C. 电解的总反应:2H2O电解(=====)2H2↑+O2↑
D. 电解过程中转移4 mol电子,理论上可获得22.4 L O2
【解析】 阴极上,H2O得电子被还原为H2,阳极上,Ni(OH)2失电子被氧化为NiOOH,电解过程总反应为2Ni(OH)2电解(=====)2NiOOH+H2↑,电解后KOH溶液的物质的量浓度不变,A、C错误;未指明是否为标准状况下,故无法计算生成O2的体积,D错误。
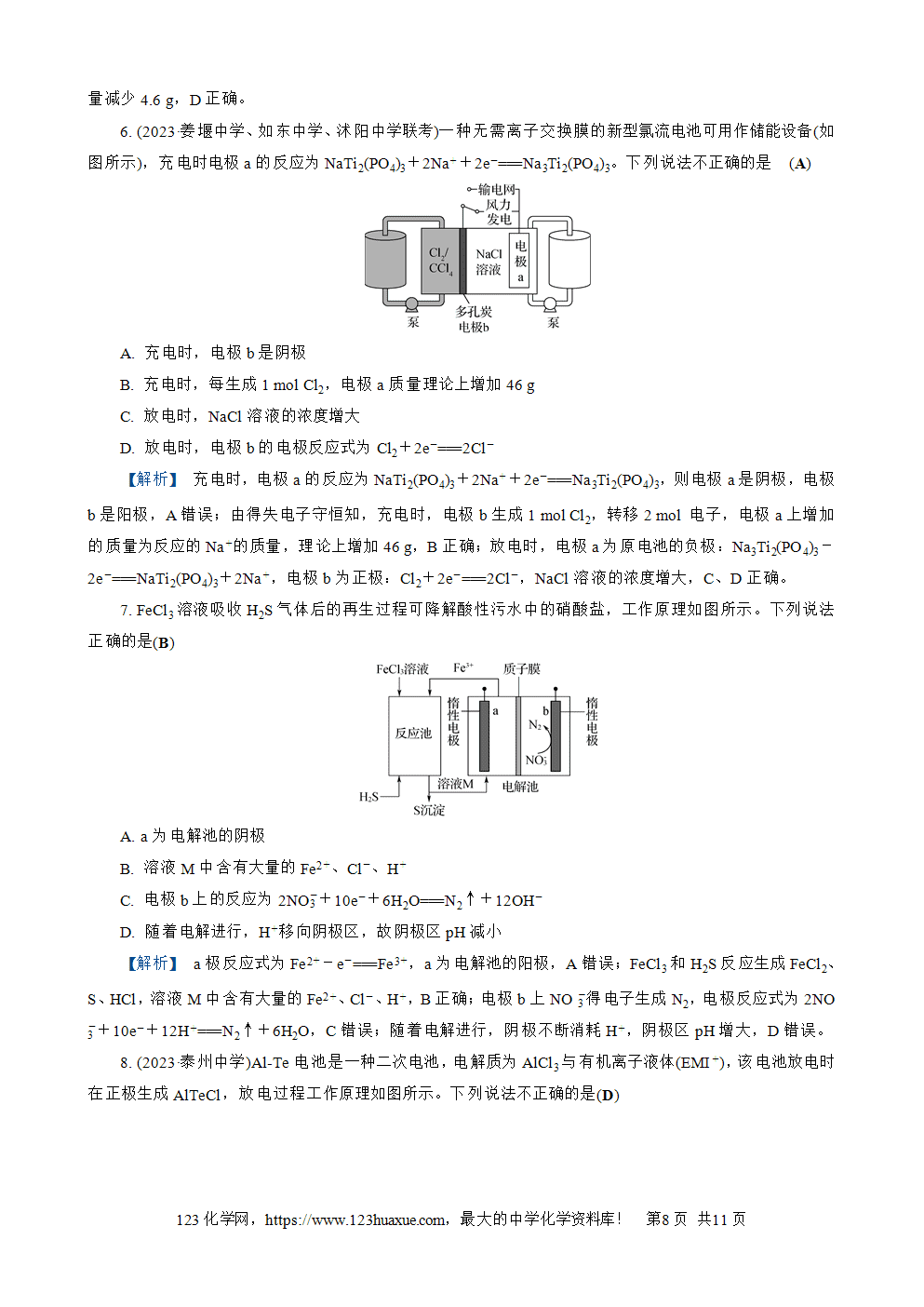
3. (2023·浙江卷)在熔融盐体系中,通过电解TiO2和SiO2获得电池材料(TiSi),电解装置如图所示。下列有关说法正确的是(C)
A. 石墨电极为阴极,发生氧化反应
B. A电极的电极反应式:8H++TiO2+SiO2+8e-===TiSi+4H2O
C. 该体系中,石墨优先于Cl-参与反应
D. 电解时,阳离子向石墨电极移动
【解析】 由图可知,在外加电源作用下,石墨电极上的C转化为CO,发生失电子的氧化反应,故石墨电极为阳极,A错误;A电极作阴极,TiO2和SiO2得到电子生成TiSi,电极反应式:TiO2+SiO2+8e-===TiSi+4O2-,B错误;石墨电极上有CO生成,无Cl2生成,故该体系中,石墨优先于Cl-参与反应,C正确;电解时,阳离子向阴极(A电极)移动,D错误。
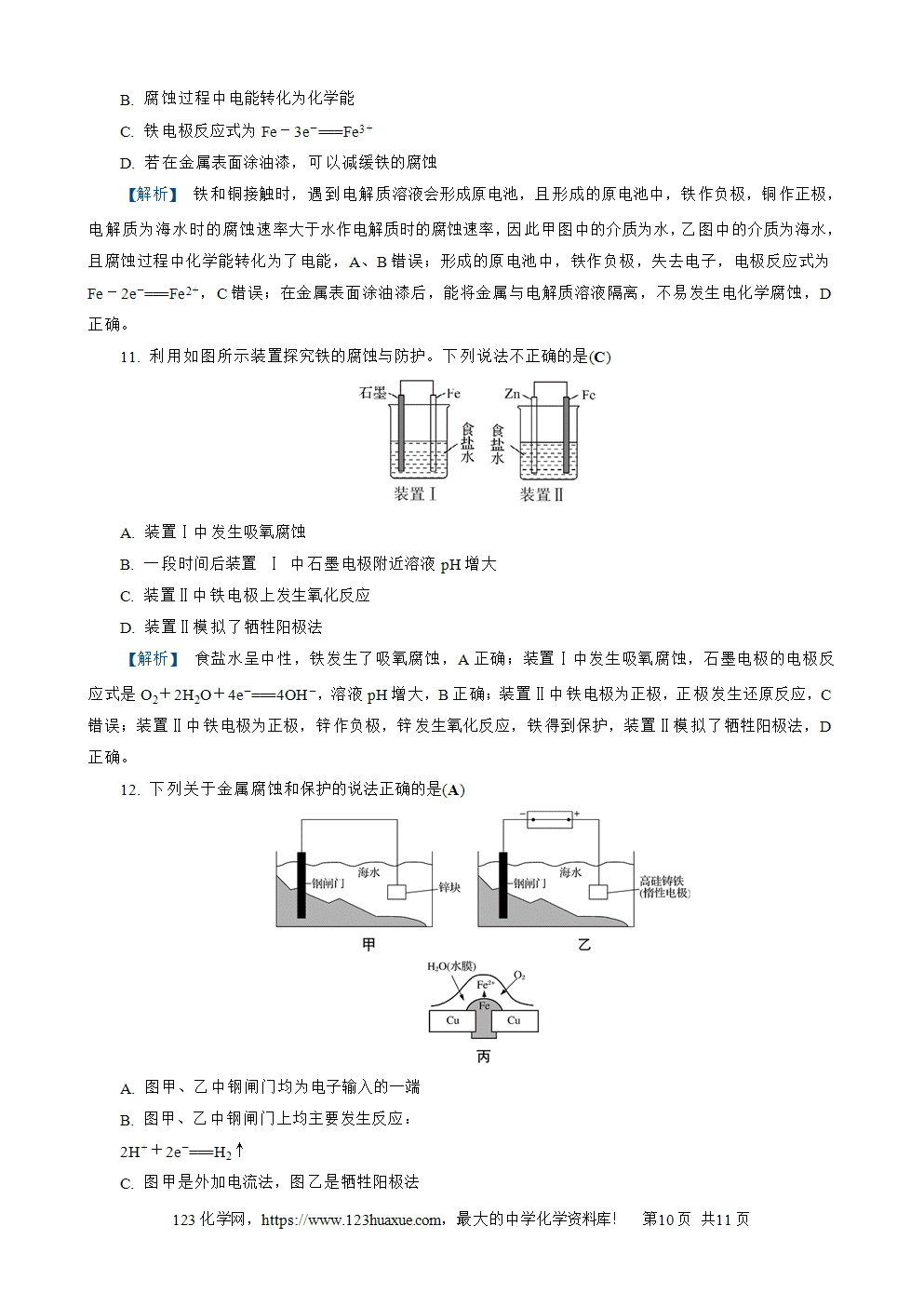
4. (2023·连云港期中)利用惰性电极电解Na2SO3和NaHSO3混合溶液分离得到二者的浓溶液,其电解装置如图所示,Ⅰ室中加入的是稀硫酸,Ⅱ室和Ⅲ室中加入的是Na2SO3和NaHSO3的混合溶液。下列说法正确的是(C)
A. 阳极上发生的电极反应:2H++2e-===H2↑
B. 交换膜a是阴离子交换膜
C. 电解一段时间后,Ⅱ室得到NaHSO3溶液
D. 电解过程中每转移1 mol电子,理论上阴极区可获得11.2 L气体
【解析】 阳极上发生失电子的氧化反应:2H2O-4e-===O2↑+4H+,A错误;Ⅰ室中的部分H+透过阳离子交换膜进入Ⅱ室,Ⅱ室中的部分Na+透过交换膜a进入Ⅲ室,故交换膜a是阳离子交换膜,B错误;电解一段时间后,Ⅱ室得到NaHSO3溶液,Ⅲ室得到Na2SO3溶液,C正确;气体所处的状况未知,无法计算体积,D错误。
5. (2023·苏州中学、淮阴中学、姜堰中学、海门中学四校联考)现有一种安全、高效的双极制氢系统,该系统能够从阳极低电压醛氧化和阴极析氢反应中得到氢气,Cu为阳极催化剂,其工作原理如图所示。下列说法正确的是(C)
A. 电压越高,阳极制氢速率越快
B. 电解过程中,阴极室的pH不变
C. 阳极发生的主要电极反应为2R—CHO-2e-+4OH-===2R—COO-+H2↑+2H2O
D. 制得1 mol氢气,理论上有2 mol OH-透过交换膜
【解析】 阳极上OH-也可能放电,故电压越高,阳极制氢速率不一定越快,A错误;阴极反应式为2H2O+2e-===H2↑+2OH-,产生的OH-移向阳极,但溶剂水减少,KOH的浓度增大,故电解一段时间后,阴极室的pH增大,B错误;铜电极为阳极,主要电极反应为2R—CHO+4OH--2e-===2R—COO-+H2↑+2H2O,C正确;阴、阳极上均产生H2,制得1 mol H2,转移1 mol电子,故理论上有1 mol OH-透过交换膜,D错误。