








考点1 碳、硅单质
知 识 梳 理
C、Si单质的结构、物理性质及用途
1. 自然界中碳元素既有游离态,又有化合态,而硅元素仅有化合态。碳单质主要有金刚石、石墨、C60、石墨烯等,它们之间的关系是互为同素异形体;硅单质主要有晶体硅和无定形硅两大类。
2. C、Si单质的物理性质与用途
(1) 金刚石:熔点高、硬度大,可作切割刀具。
(2) 晶体硅:灰黑色固体,有金属光泽、硬度大、熔点高,可用作半导体材料、硅芯片和硅太阳能电池板。
(3) 石墨:熔点高、质软、有滑腻感、能导电,可用作铅笔芯、电极。
(4) 石墨烯:石墨烯就是单层石墨,有优良的导电性能。
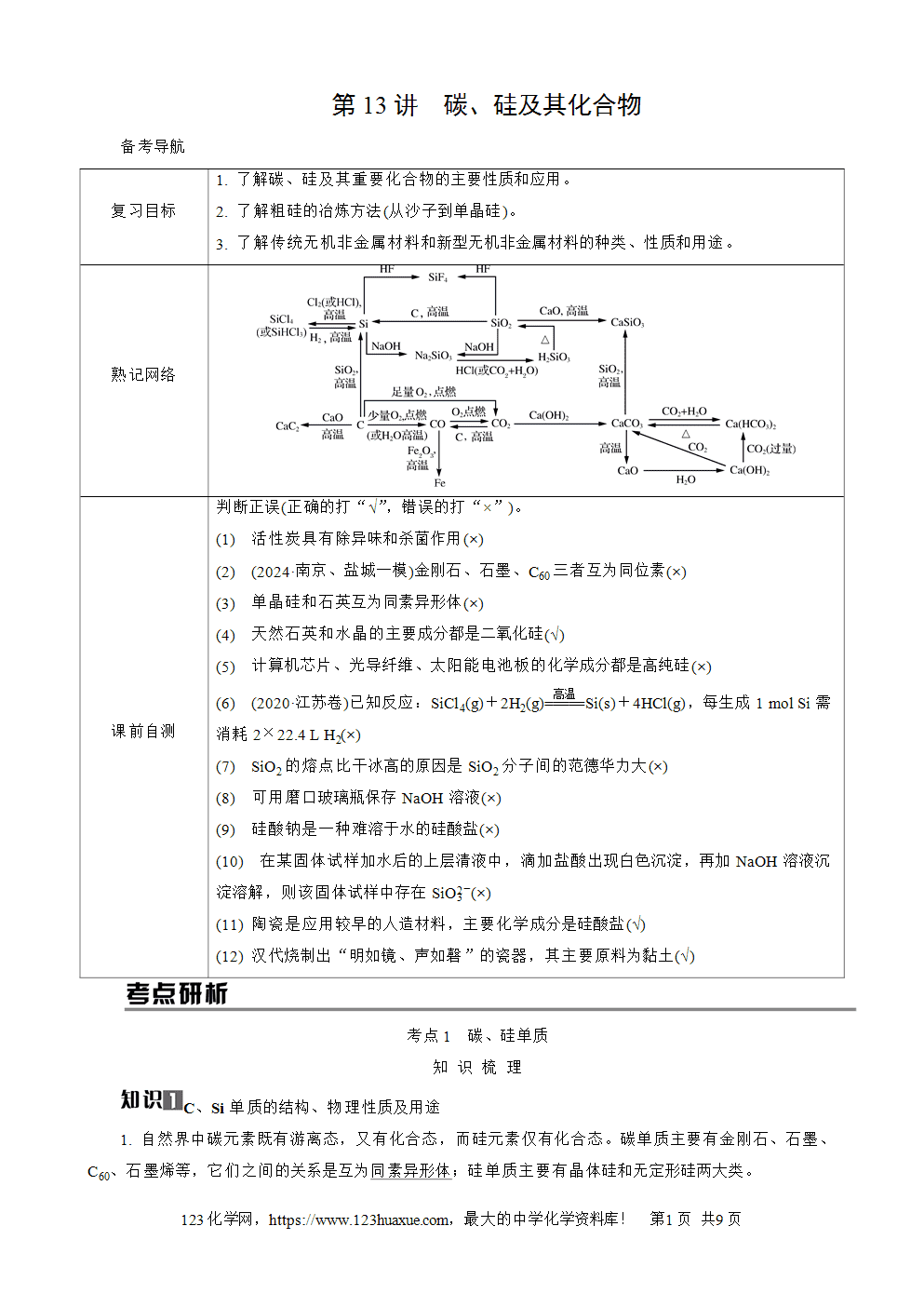
3. C60结构分析
C60(如图所示)是由60个C原子形成的封闭笼状分子,形似足球的32面体,有20个六边形和12个五边形。
碳的化学性质
1. 与氧气反应
C+O2点燃(=====)CO2(O2足量);
2C+O2点燃(=====)2CO(O2少量)。
2. 与氧化物反应
(1) C+CO2高温(=====)2CO;
(2) 3C+2Fe2O3高温(=====)4Fe+3CO2↑。
(3) C+H2O高温(=====)CO+H2(工业制水煤气)
3. 与强氧化性酸反应
C+2H2SO4(浓)△(=====)CO2↑+2SO2↑+2H2O;
C+4HNO3(浓) △(=====)CO2↑+4NO2↑+2H2O。
硅的化学性质
1. 与O2反应:Si+O2△(=====)SiO2
2. 与F2、Cl2反应
Si+2F2===SiF4、Si+2Cl2△(=====)SiCl4
3. 与氯化氢反应
Si+3HCl300 ℃(=====)H2+SiHCl3
4. 与氢氟酸反应(写化学方程式,下同):
Si+4HF===SiF4↑+2H2↑。
5. 与NaOH溶液反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
高纯硅的制备
1. 原料:焦炭和石英。
2. 粗硅的制备:SiO2+2C高温(=====)Si+2CO↑。
3. 粗硅的提纯:Si+3HCl300 ℃(=====)H2+SiHCl3、H2+SiHCl3 1 100 ℃(=====)Si+3HCl
典 题 悟 法
物质的转化
(2024·江苏各地模拟重组)下列化学方程式书写错误的是(C)
A. Si+4HF===SiF4↑+2H2↑
B. Si+2NaOH+H2O===Na2SiO3+2H2↑
C. Si+4HCl(aq)===SiCl4+2H2↑