




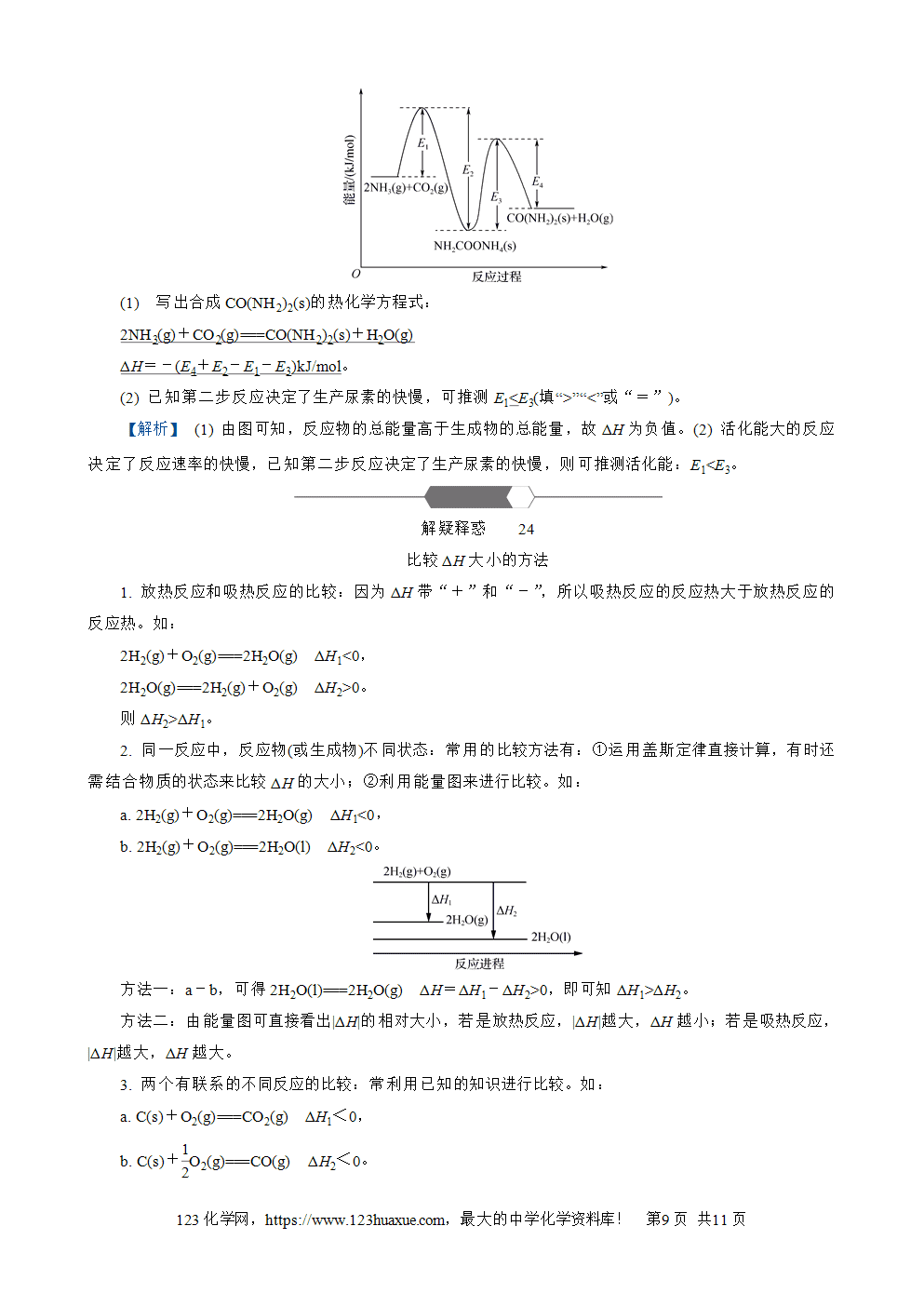

1. 反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热(苏教版定义:在化学反应过程中,当反应物和生成物具有相同温度时,吸收或释放的热)。
2. 焓变:等压条件下进行的化学反应,其反应热等于反应的焓变(苏教版定义:在恒压的条件下,化学反应过程中吸收或释放的热)。
3. 常见的放热反应和吸热反应
(1) 放热反应
①所有的燃烧反应:
如CH4+2O2点燃(=====)CO2+2H2O
②中和反应:
如NaOH+HCl===NaCl+H2O
③金属与酸反应:
如Mg+2HCl===MgCl2+H2↑
④铝热反应:
如2Al+Fe2O3高温(=====)Al2O3+2Fe
⑤碱性氧化物与水反应:
如CaO+H2O===Ca(OH)2
⑥大多数化合反应:
如N2+3H2高温、高压2NH3
(2) 吸热反应
①制水煤气:
C+H2O(g)高温(=====)CO+H2
②高炉炼铁中还原气CO的制备:
C+CO2高温(=====)2CO
③Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
④盐类水解:
如NH4(+)+H2ONH3·H2O+H+
⑤大多数分解反应:
如CaCO3高温(=====)CaO+CO2↑
4. 放热、吸热的理论分析
(1) 从能量图的角度分析
①放热反应
②吸热反应
(2) 从化学键的角度分析
化学键断裂和形成的能量变化是化学反应中能量变化的主要原因。
热化学方程式
1. 概念:表明反应所释放或吸收的热量的化学方程式(苏教版定义:能够表示反应热的化学方程式)。
2. 意义:例如H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ/mol,表明了1 mol气态H2和1 mol气态Cl2反应生成2 mol气态HCl时,放出184.6 kJ的热量。
3. 书写步骤:
(1) 写化学方程式。
(2) 标各物质的状态。
(3) 标ΔH。
①需要注明反应时的温度和压强,但一般用25 ℃和101 kPa时的数据,因此可不特别注明;
②注明物质的聚集状态:常用s、l、g、aq分别表示固态、液态、气态、溶液;
③各物质化学式前面的化学计量数表示物质的量,可以是整数,也可以是分数,化学计量数与ΔH数值相对应,ΔH应包括“+”或“-”、数值和单位(kJ/mol);
④一般不要求写反应条件,不用标“↑”和“↓”,生成符不用“―→”,而用“===”或“”;
⑤如果是可逆反应,那么正反应和逆反应ΔH的数值相等,符号相反。
如CO(g)+H2O(g)CO2(g)+H2(g)