





1. 判断正误(正确的打“√”,错误的打“×”)。
(1) (2020·江苏卷)氧化铝熔点高,故可用作电解冶炼铝的原料(×)
(2) (2019·江苏卷)Al2O3具有两性,故可用于电解冶炼铝(×)
(3) 电解精炼铜时,电解质溶液的浓度不变(×)
(4) 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属(×)
(5) 电镀时,应把待镀金属置于电解槽的阴极(√)
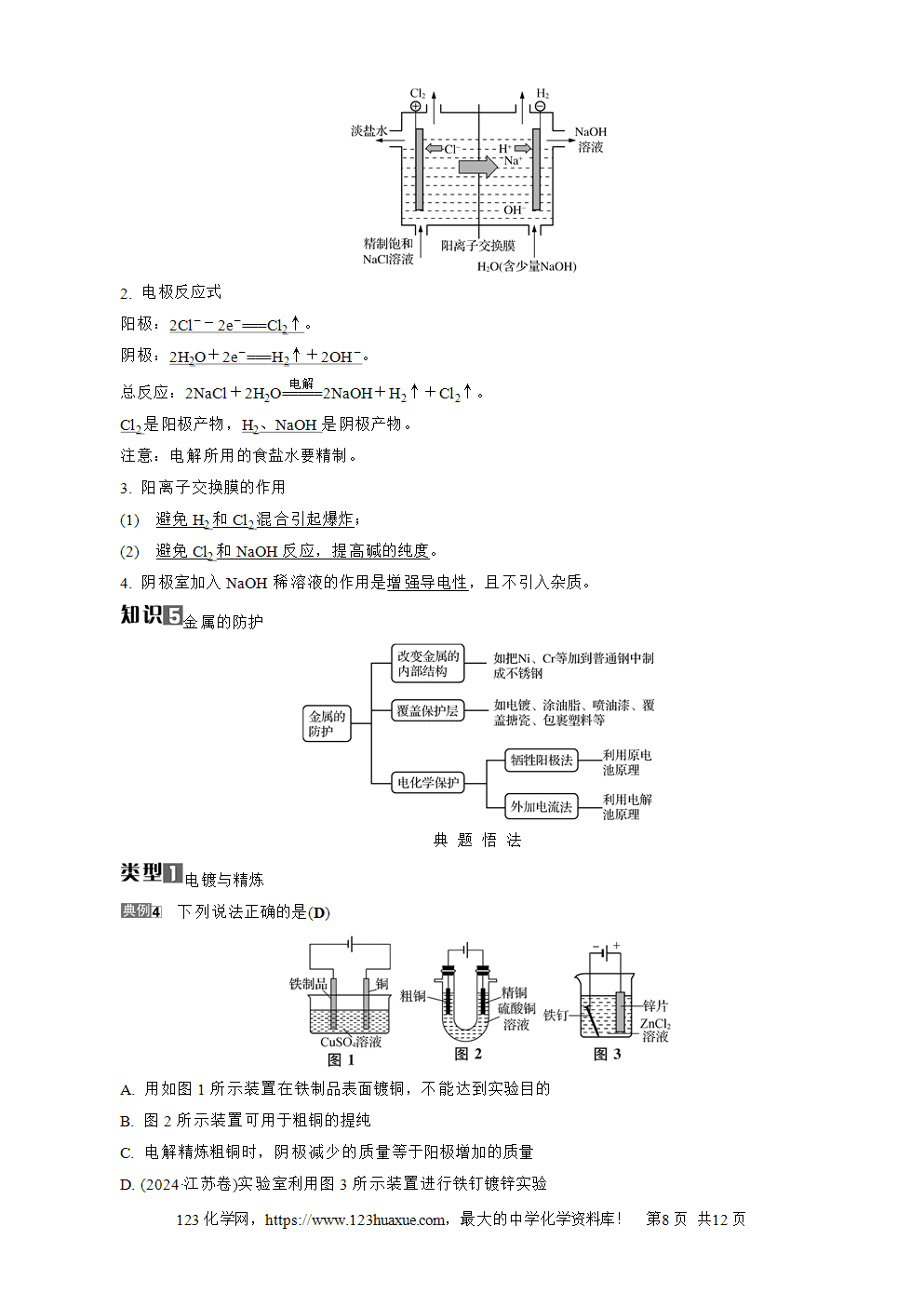
(6) (2017·江苏卷)电解饱和食盐水获取烧碱和氯气:
2Cl-+2H2O电解(=====)H2↑+Cl2↑+2OH-(√)
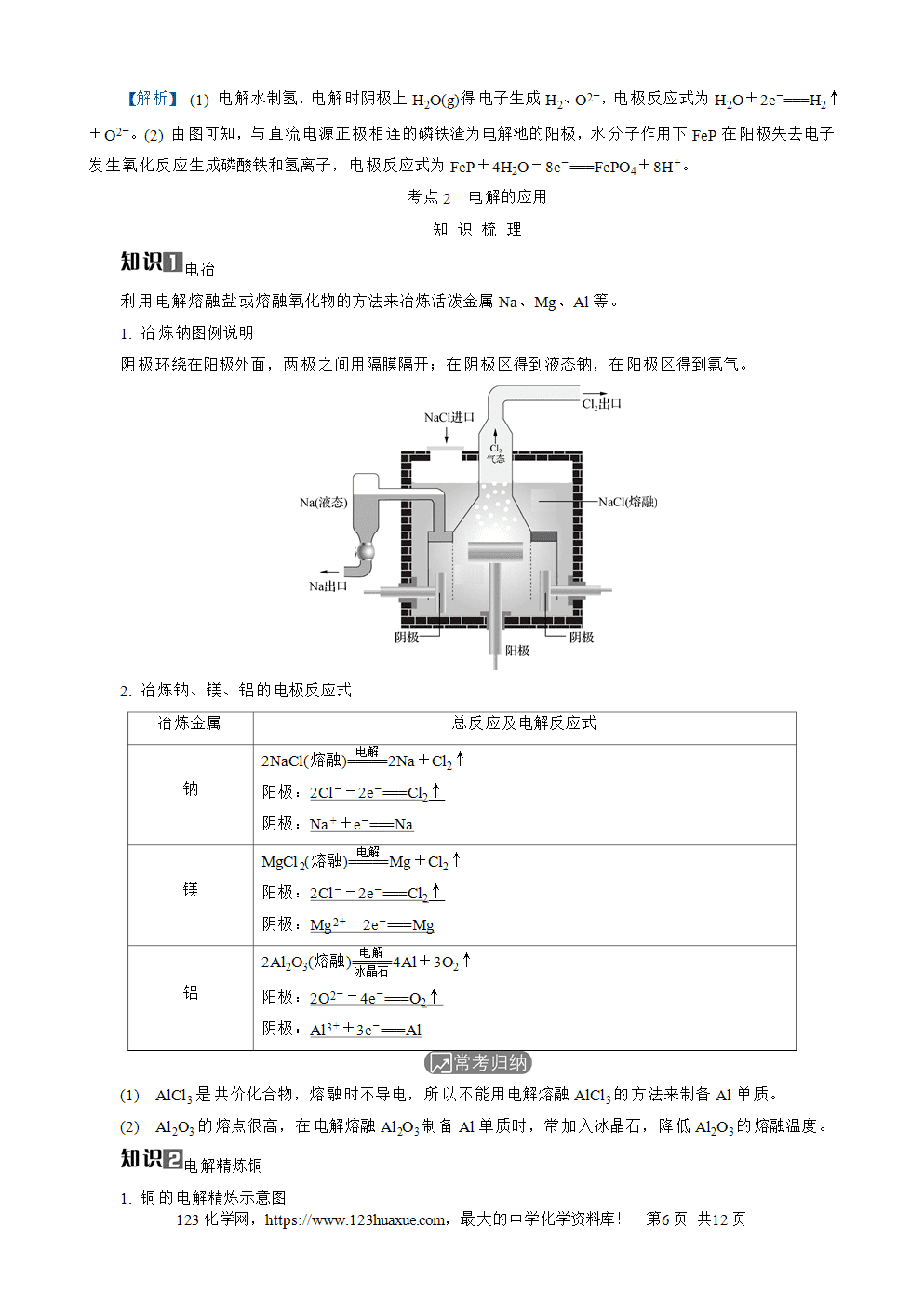
(7) (2022·浙江卷)工业上通过电解六水合氯化镁制取金属镁(×)
2. 完成下列填空。
(8) (2024·南京外国语学校) 电解含Na3SbS3、Na2S、NaOH的溶液制备Sb的过程中,阳极上发生的两个电极反应,分别为4OH--4e-===O2↑+2H2O、S2--2e-===S。
(9) (2022·江苏卷)某电解池的阳极区为酸性CuCl2(-)溶液,阴极区为盐酸,电解过程中CuCl2(-)转化为CuCl4(2-)。电解时阳极发生的主要电极反应式为CuCl2(-)+2Cl--e-===CuCl4(2-)。
电解池的定义及工作原理
1. 定义:将电能转化为化学能的装置叫电解池。
2. 工作原理(以用惰性电极电解CuCl2溶液为例)
(1) 电极反应式。
阴极:Cu2++2e-===Cu
阳极:2Cl--2e-===Cl2↑
(2) 总反应:CuCl2电解(=====)Cl2↑+Cu。
(3) 电子流向:阳极→正极,负极→阴极。
(4) 离子迁移方向:阴离子移向阳极,阳离子移向阴极。
阴、阳极的判断
1. 阴、阳极的判断依据
(1) 依据外接电源判断:与外接电源正极相连的一极是阳极,与外接电源负极相连的一极是阴极。
(2) 依据电子流向判断:电子流出的一极是阳极,电子流入的一极是阴极。
(3) 依据电极反应判断:得到电子发生还原反应的一极是阴极,失去电子发生氧化反应的一极是阳极。
(4) 依据离子迁移方向判断:阴离子移向的一极是阳极,阳离子移向的一极是阴极。
(5) 依据电极现象判断:一般质量减小或产生氧气、氯气的一极是阳极,质量增大或产生氢气或电极附近溶液能使无色酚酞变红的一极是阴极。
2. 阴、阳极放电分析
(1) 阴极(发生还原反应)放电顺序:
①阴极材料不参与放电,一般是电解液(或熔融电解质)中的阳离子在阴极上得电子。
②常见阳离子得电子顺序:Cu2+>H+(酸)>Fe2+>Zn2+>H2O。溶液中K+、Ca2+、Na+、Mg2+、Al3+等不参与放电。
(2) 阳极(发生氧化反应)放电顺序:
①若阳极为金属电极(除Pt、Au外的其他金属),如Fe和Cu,则阳极材料直接失去电子(阳极材料被消耗)。
②若阳极为惰性电极(如C、Pt、Au),则阳极材料不参与放电,一般是电解液(或熔融电解质)中的阴离子在阳极上失电子。常见阴离子失电子顺序:S2->I->Br->Cl->OH-。NO3(-)、SO4(2-)等不参与放电,由溶液中的H2O去放电。