


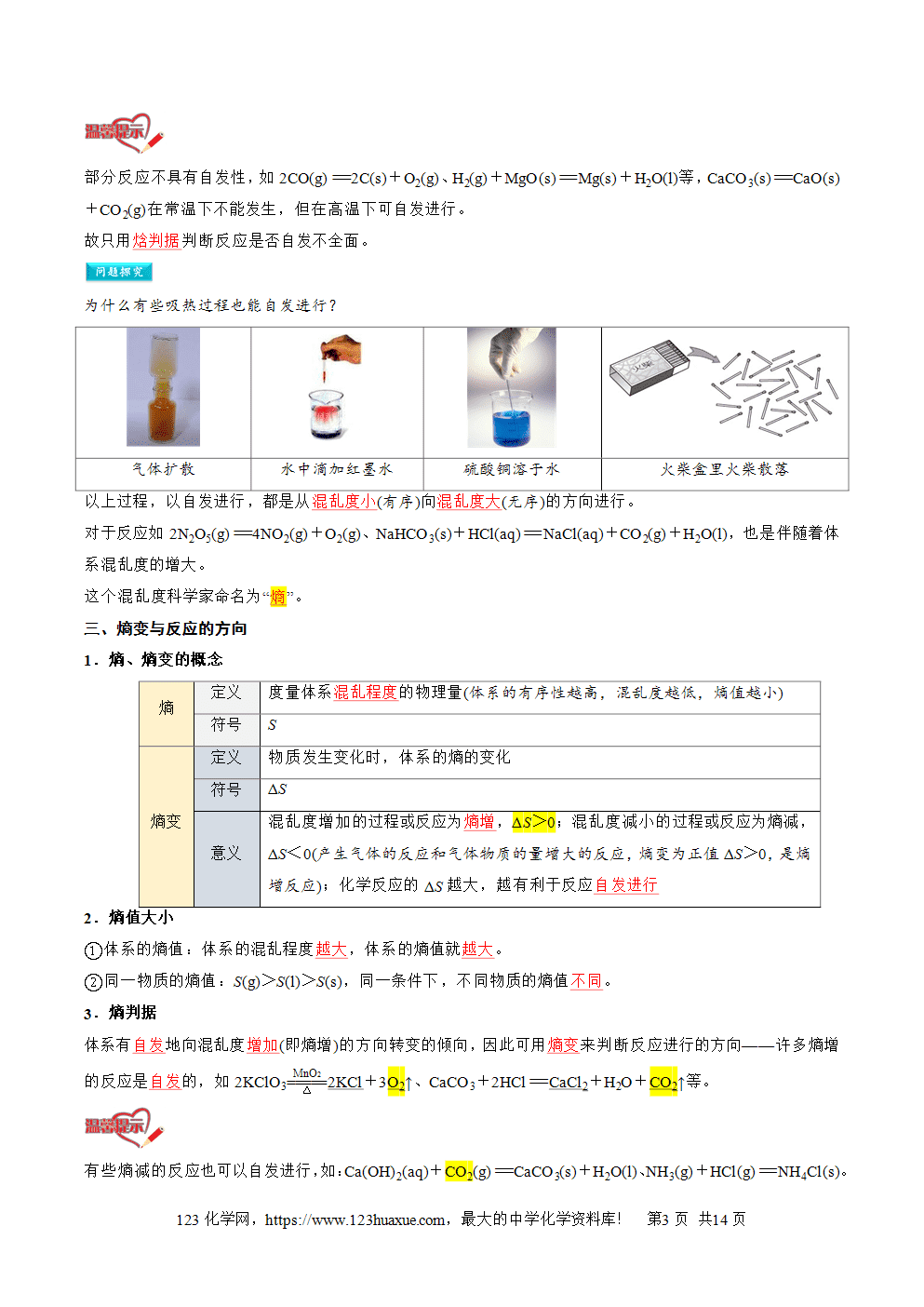









1.不能认为自发反应都是不需要任何条件就能发生的,自发反应的“一定的条件”,可以是一定的温度和压强,可以是“点燃、光照、加热、高温”等给反应物提供能量的条件,“外界帮助”指通电、放电等,如氢气的燃烧是自发的通过需点燃才能发生;也不能认为非自发反应在任何条件下都是不能发生的,如NaCl在通电条件可分解生成Na和Cl2。
2.不能认为自发反应应用普通,非自发反应没有应用价值。将电能、热能转化为化学能的许多非自发反应是制备物质的重要反应,如电解法去冶炼钠、镁、铝和制取氯气等。
3.反应能否自发进行与反应速率无关。
以下反应均可自发进行,这是为什么?
H2(g)+F2(g)=2HF(g) ΔH=-546.6 kJ·mol-1 2K(s)+2H2O(l)=2KOH(aq)+H2(g) ΔH=-393.62 kJ·mol-1 4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1 648.4 kJ·mol-1。
放热反应过程中体系能量降低,因此具有自发进行的倾向,科学家提出用焓变(能量变化)来判断反应进行的方向,这就是焓判据(能量判据)。
那么,对于吸热反应能否自发进行?
以下两反应,也能自发进行:
2N2O5(g)=4NO2(g)+O2(g) ΔH=+109.8 kJ·mol-1
NaHCO3(s)+HCl(aq)=NaCl(aq)+CO2(g)+H2O(l) ΔH=+31.4 kJ·mol-1。