



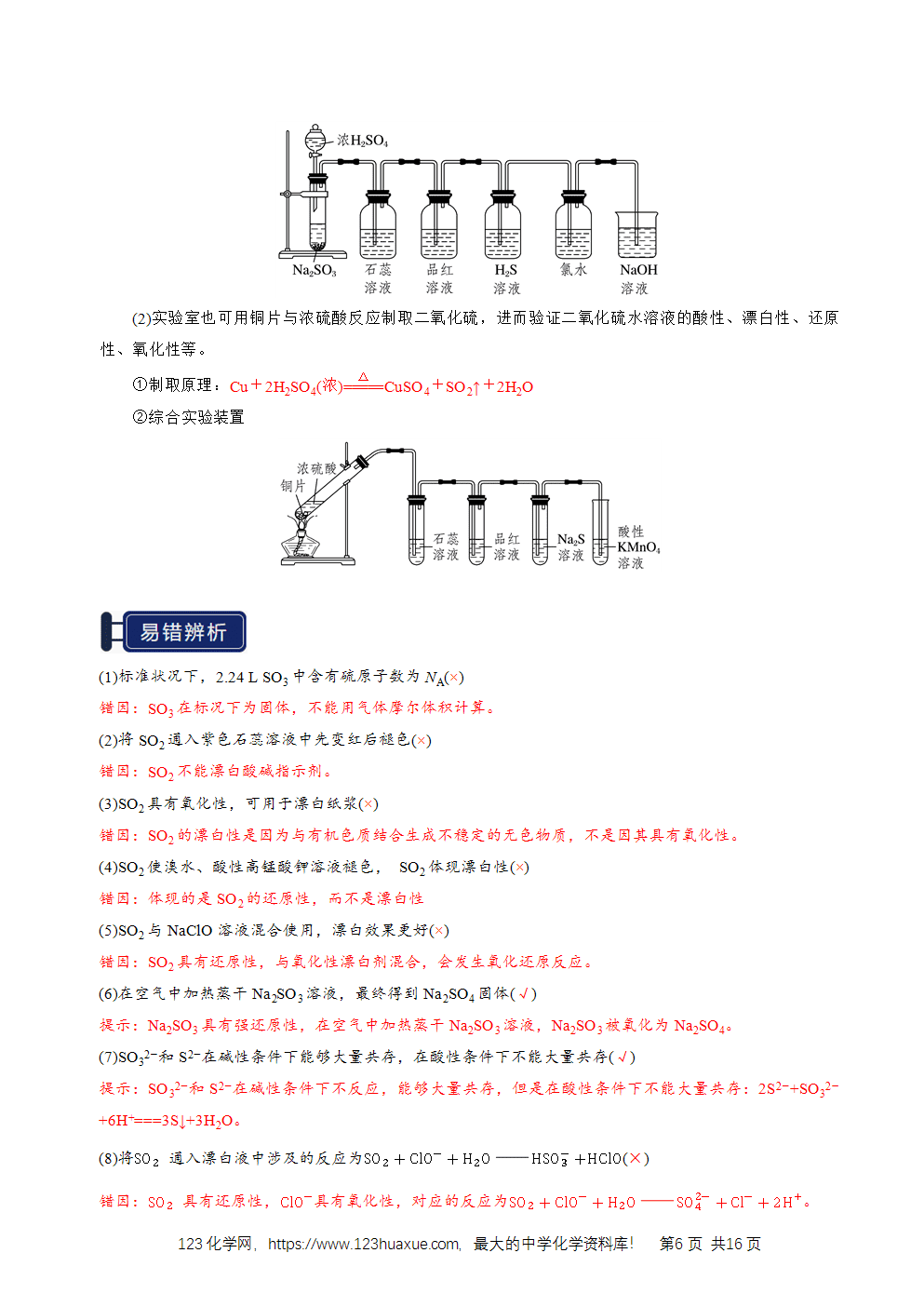





1.硫元素的存在形态
游离态:火山口附近或地壳的岩层里;
化合态:主要以硫化物和硫酸盐的性质存在。
2.硫的物理性质
黄色或淡黄色固体;俗称硫黄,质脆,易研成粉末,密度比水大,难溶于水,微溶于酒精,易溶于CS2。
3.硫的化学性质
-2(S)氧化性(←――――)(S)还原性(――→)+4(S)
(1)与非金属单质反应
与氧气反应:S+O2点燃(=====)SO2
与氢气反应:S+H2△(=====)H2S
(2)与金属反应
与钠反应:2Na+S===Na2S
与铁反应:Fe+S△(=====)FeS
与铜反应:2Cu+S△(=====)Cu2S
与汞反应:Hg+S===HgS 应用:去除洒落的汞
硫与变价金属反应生成低价态化合物
(3)与NaOH溶液反应:3S+6NaOH△(=====)2Na2S+Na2SO3+3H2O 应用:清洗试管壁残留的硫
(1)硫与Fe反应生成FeS,与Cu反应生成CuS(×)
错因:硫与变价金属反应时,生成低价态金属硫化物(如Cu2S、FeS)2。
(2)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理(√)
(3)硫与少量的O2反应生成SO2,与过量的O2反应生成SO3(×)
错因:硫燃烧只能生成SO2,与O2的量无关,SO2与O2反应生成SO3,需要温度较高,且有催化剂存在才可以。