




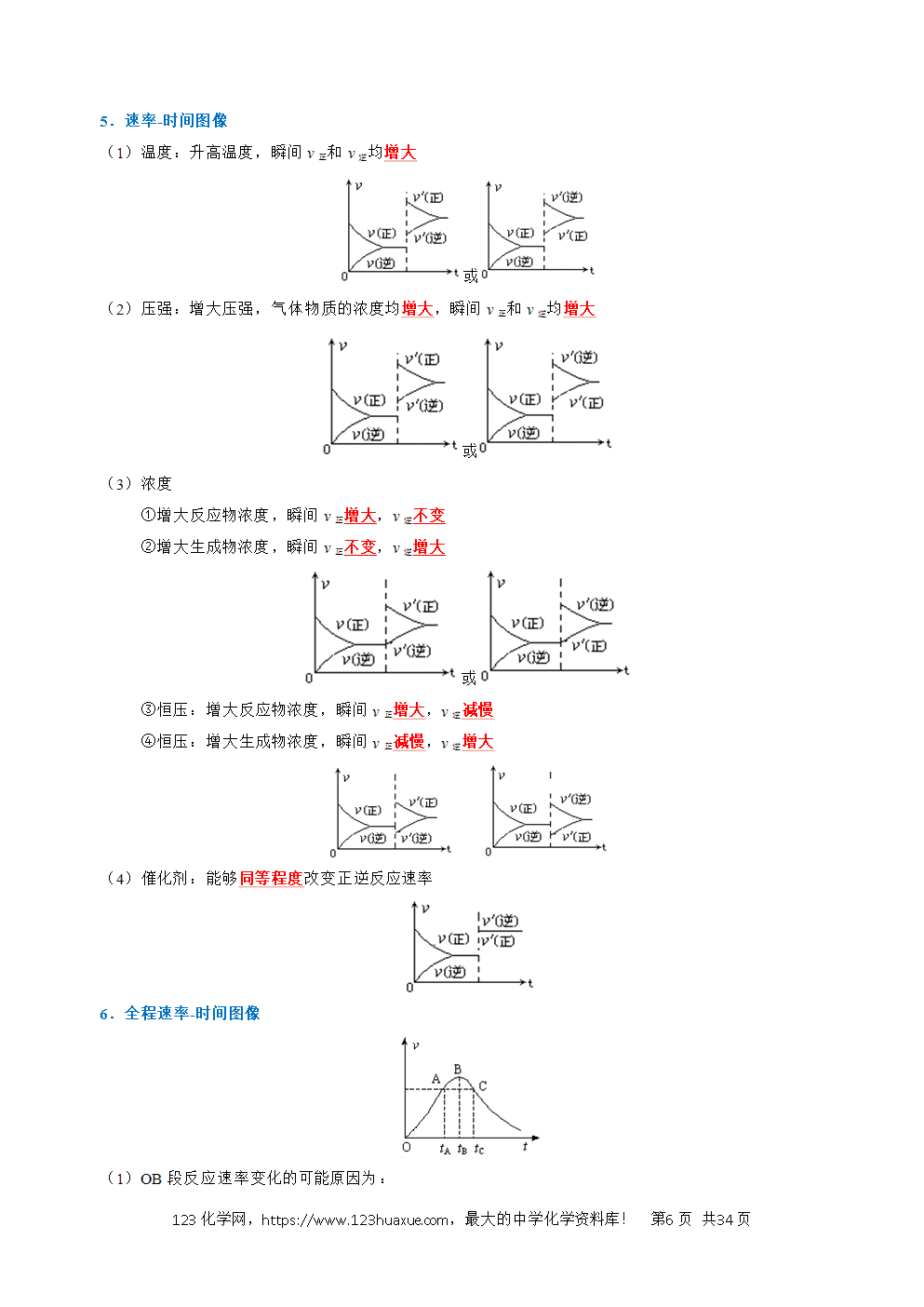











1.概念:用来衡量化学反应进行快慢的物理量
2.表示:单位时间内某种量的变化量
3.化学反应速率的计算
(1)常规公式:v==
①常用单位:mol·L-1·s-1或mol·L-1·min-1或mol·L-1·h-1
②适用范围:表示气体物质或溶液中可溶性物质的速率,不表示固体或纯液体物质的速率
(2)非常规公式:v=(X代表n、P、m、V等量)
①常用单位:mol·min-1、Pa·min-1、g·min-1、L·min-1
②适用范围:任何物质的反应速率
(3)利用关系式计算
①应用前提:同一化学反应
②常用关系:速率比=化学计量数比=物质的量浓度变化比=物质的量变化比
4.大小比较
(1)比较前提:同一反应,同一物质,同一单位
(2)换算方法:各物质的速率除以相应的化学计量数,数大的速率快
5.速率大小比较“三步骤”
(1)“一看”单位是否一致,不一致转化为同一单位。
(2)“二化”将不同物质表示的反应速率转化为同一物质表示的化学反应速率。
(3)“三比较”比较数值大小。
6.比较反应速率快慢的常用方法:
(1)定性描述——通过在相同时间点,不同的实验现象来判断反应的快慢。
①观察产生气泡的快慢;
②观察试管中剩余锌粒的多少;
③用手接触试管,感受试管外壁温度的高低。
(2)定量描述——通过实验测量来判断反应的快慢。
①测定气体的体积或体系的压强;
②测定物质的物质的量的变化;
③测定物质或离子的浓度变化;
④测定体系的温度或反应的热量变化。
若有多种测量方案时,一般采取易操作,现象明显的实验方案。
7.【提醒】
(1)化学反应速率表示某段时间内的平均反应速率,不表示即时速率
(2)化学反应速率只有正值,没有负值
(3)随着反应的进行,反应物的浓度等量逐渐减小,反应速率越来越慢