


微题型30 碳酸钠与碳酸氢钠
1.某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
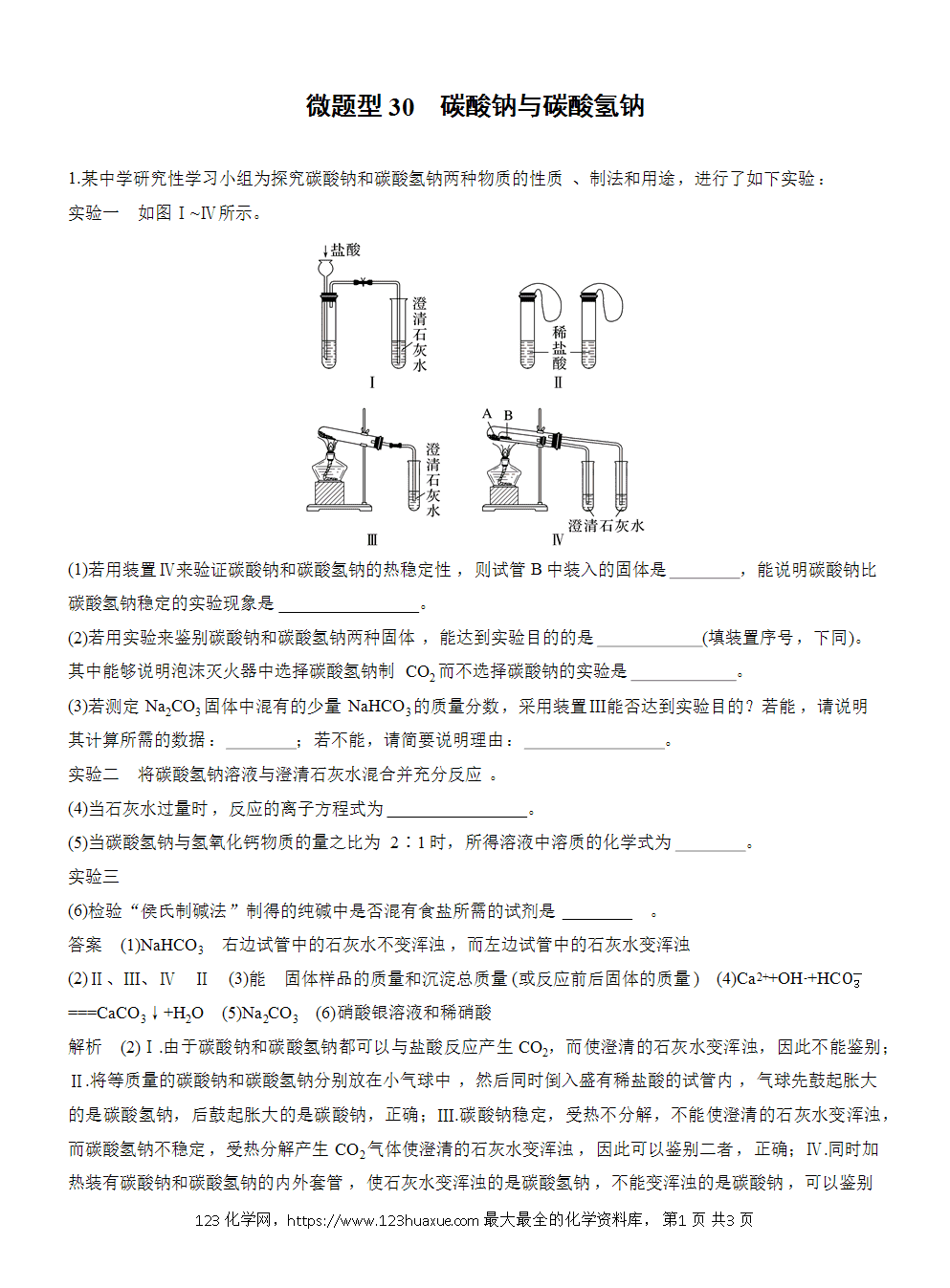
实验一 如图Ⅰ~Ⅳ所示。
(1)若用装置Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体是 ,能说明碳酸钠比碳酸氢钠稳定的实验现象是 。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是 (填装置序号,下同)。其中能够说明泡沫灭火器中选择碳酸氢钠制CO2而不选择碳酸钠的实验是 。
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,采用装置Ⅲ能否达到实验目的?若能,请说明其计算所需的数据: ;若不能,请简要说明理由: 。
实验二 将碳酸氢钠溶液与澄清石灰水混合并充分反应。
(4)当石灰水过量时,反应的离子方程式为 。
(5)当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,所得溶液中溶质的化学式为 。
实验三
(6)检验“侯氏制碱法”制得的纯碱中是否混有食盐所需的试剂是 。
答案 (1)NaHCO3 右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊
(2)Ⅱ、Ⅲ、Ⅳ Ⅱ (3)能 固体样品的质量和沉淀总质量(或反应前后固体的质量) (4)Ca2++OH-+HC===CaCO3↓+H2O (5)Na2CO3 (6)硝酸银溶液和稀硝酸
解析 (2)Ⅰ.由于碳酸钠和碳酸氢钠都可以与盐酸反应产生CO2,而使澄清的石灰水变浑浊,因此不能鉴别;Ⅱ.将等质量的碳酸钠和碳酸氢钠分别放在小气球中,然后同时倒入盛有稀盐酸的试管内,气球先鼓起胀大的是碳酸氢钠,后鼓起胀大的是碳酸钠,正确;Ⅲ.碳酸钠稳定,受热不分解,不能使澄清的石灰水变浑浊,而碳酸氢钠不稳定,受热分解产生CO2气体使澄清的石灰水变浑浊,因此可以鉴别二者,正确;Ⅳ.同时加热装有碳酸钠和碳酸氢钠的内外套管,使石灰水变浑浊的是碳酸氢钠,不能变浑浊的是碳酸钠,可以鉴别二者,正确;故能达到实验目的的是Ⅱ、Ⅲ、Ⅳ;其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是Ⅱ。(3)采用装置Ⅲ能测定Na2CO3固体中混有的少量NaHCO3的质量分数,需要的数据是反应前后固体的质量;减少的质量是CO2、H2O的质量和,根据方程式:2NaHCO3Na2CO3+CO2↑+H2O可以计算出NaHCO3的质量,就可以得到NaHCO3的质量分数;或需要固体样品的质量和沉淀总质量,根据发生反应:CO2+Ca(OH)2===CaCO3↓+H2O,产生的沉淀的质量就可以计算CO2的质量,再利用2NaHCO3Na2CO3+CO2↑+H2O中CO2与NaHCO3之间的关系得到NaHCO3的质量,进而得到NaHCO3的质量分数。(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当石灰水过量时,以不足量的碳酸氢钠为标准,反应的离子方程式为Ca2++OH-+HC===CaCO3↓+H2O。(5)当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,发生反应:Ca2++2OH-+2HC===CaCO3↓+H2O+C;所得溶液中溶质的化学式为Na2CO3。(6)检验“侯氏制碱法”制得的纯碱中是否混有食盐的方法是将物质溶于水,向其中加入足量的稀硝酸,Na2CO3与硝酸发生反应生成CO2,然后向溶液中加入硝酸银溶液,若产生白色沉淀,就证明含有Cl-,即含有氯化钠,故鉴别试剂是硝酸银溶液和稀硝酸。