













1.硫单质的物理性质
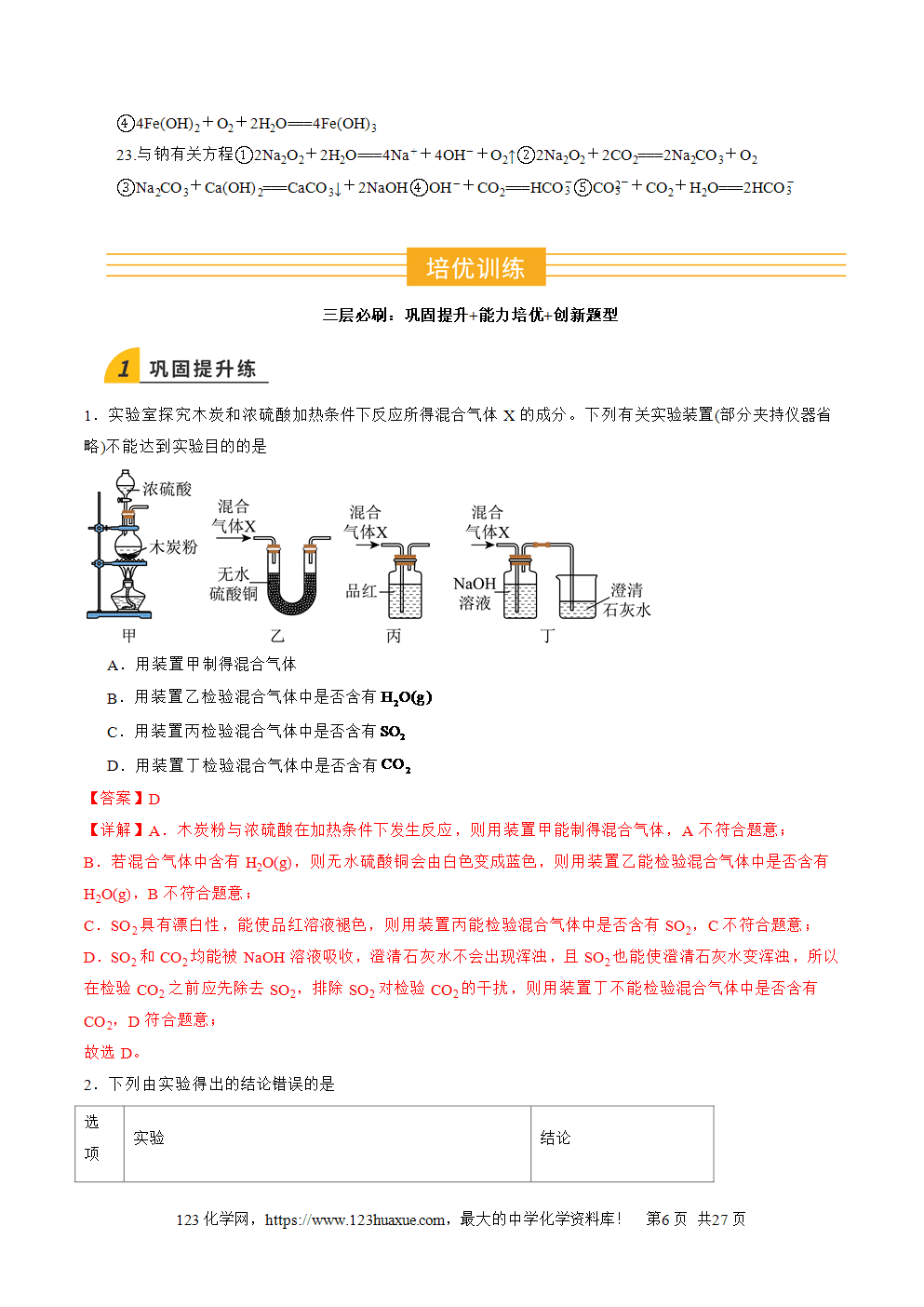
硫单质俗称硫黄,是一种淡黄色固体;不溶于水,微溶于酒精,易溶于CS2;有多种同素异形体,如单斜硫、斜方硫等。
2.S的氧化性
S与Fe、Cu、Hg、H2反应的化学方程式依次为
①Fe+SFeS(黑色难溶于水的物质,可溶于盐酸、稀硫酸)
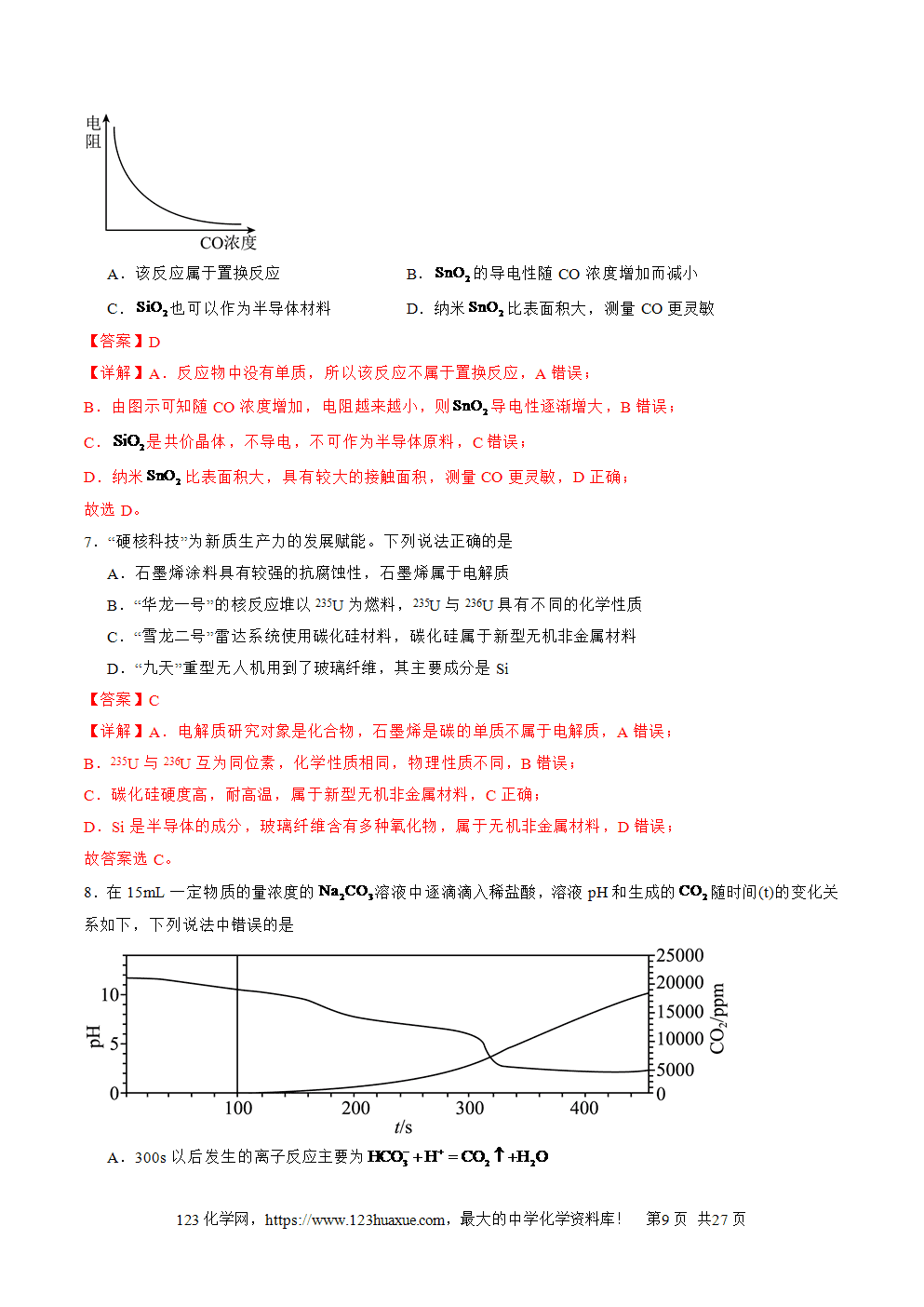
②2Cu+SCu2S(黑色难溶于水的物质,不溶于盐酸、稀硫酸)
③S+Hg===HgS(此反应适用于除去室内洒落的Hg)
④H2+SH2S(臭鸡蛋气味的气体)。
3.S的还原性
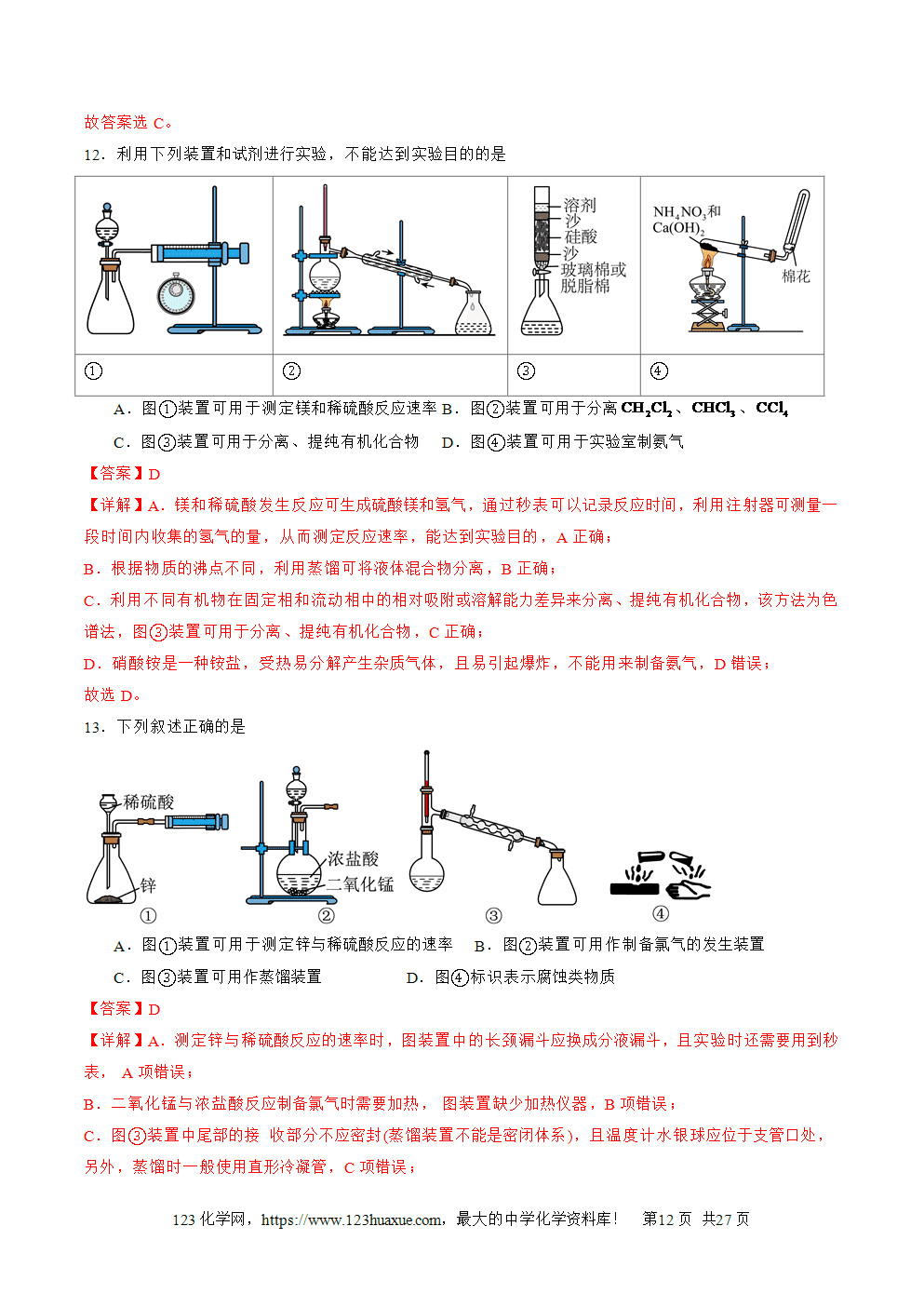
①S与O2反应的化学方程式为S+O2点燃(=====)SO2,在空气中燃烧火焰为淡蓝色。
②与强氧化剂反应(如浓硫酸)的化学方程式为:S+2H2SO4(浓)3SO2↑+2H2O。
既体现S的氧化性又体现S的还原性:S与NaOH溶液反应的化学方程式为:
3S+6NaOH2Na2S+Na2SO3+3H2O
该反应中硫既是氧化剂,又是还原剂,此反应可用于除去试管内黏附的S。
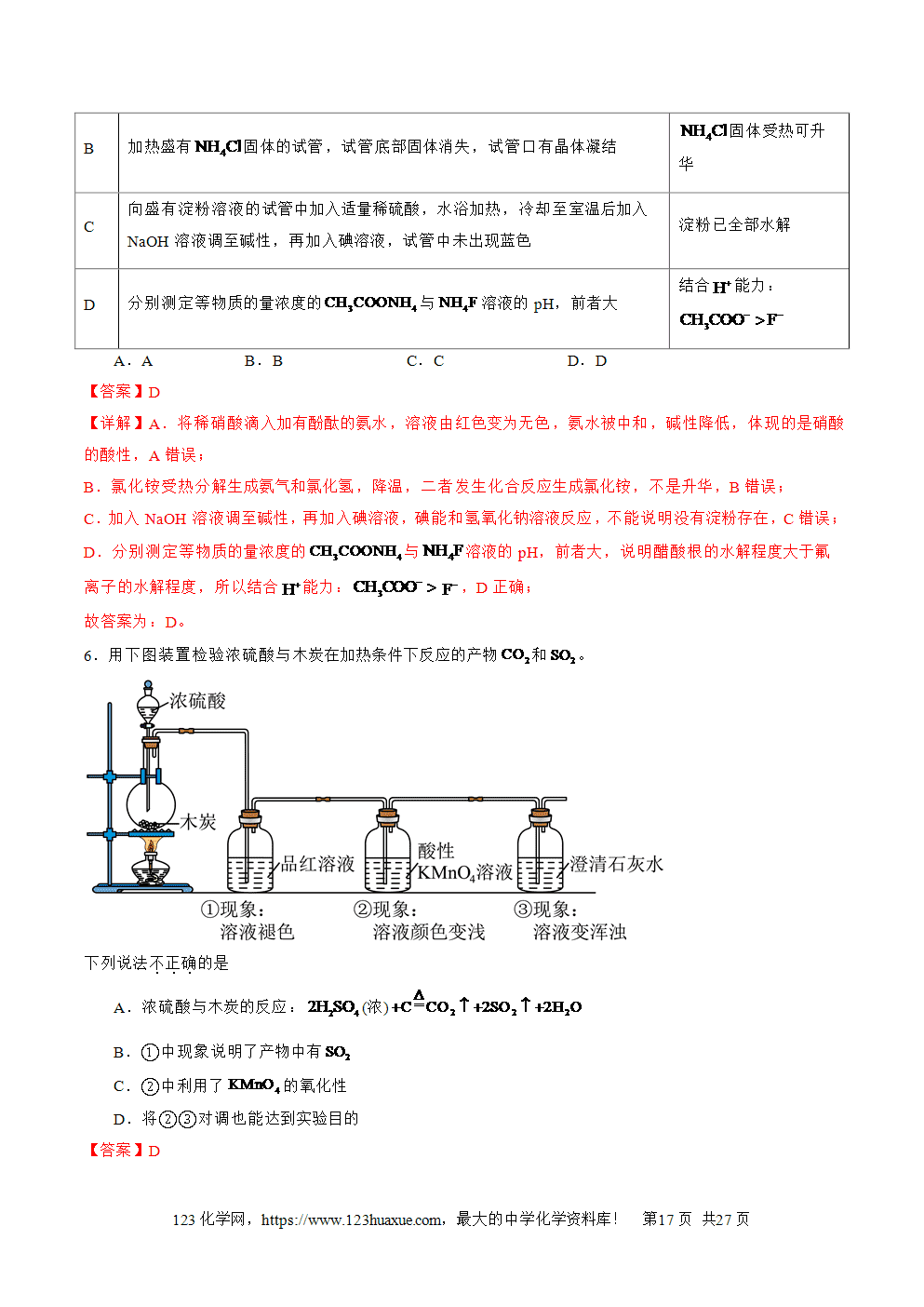
4.二氧化硫是无色、有刺激性气味的有毒气体,密度比空气的大,是大气污染物之一;易溶于水,通常状况下,1体积水溶解约40体积SO2。
5.酸性氧化物的通性:
a.与水反应:SO2+H2OH2SO3(可逆反应);H2SO3是中强酸,水溶液能使紫色石蕊试液变红色。
b.与NaOH(足量)反应:2NaOH+SO2===Na2SO3+H2O,应用:用NaOH溶液吸收SO2尾气;
与澄清石灰水反应:SO2+Ca(OH)2=CaSO3↓+H2O,与CO2性质相似。
c.与碱性氧化物(CaO)反应反应:CaO+SO2===CaSO3。
d.与盐(NaHCO3)溶液反应:NaHCO3+SO2===NaHSO3+CO2;Na2SO3溶液中通入SO2气体:Na2SO3+SO2+H2O=2NaHSO3。
②氧化性(如与H2S溶液反应):
SO2+2H2S===3S↓+2H2O