化学反应速率与平衡是化学反应原理模块中的重要组成部分,涉及宏观辨识与微观探析、变化观念与平衡思想以及证据推理与模型认知等多重学科素养。近年来,选择题在自主命题省份的试卷中有不同程度的呈现,有的省份出现的概率达到100%。选择题的题干多为文字+图像,文字部分主要给出题设情境和研究对象,图像部分给出与物质的量相关的数据与时间、温度等的变化曲线,所给的研究对象一般为复杂动态的,包含多个不同的反应;所给的图像一般含有多条曲线,分为给出曲线含义和未给曲线含义两种情况,主要图绕外界条件对化学反应速率和化学平衡移动的影响设置,包括定性的分析和定量的计算,主要以定性的分析为主。从近年高考题的情况来看,根据研究对象及变化数据和规律所给的形式可将本专题分为4个热点:一是反应速率与平衡及其图像分析;二是反应速率与平衡及其表格分析;四是多重平衡及其图像分析;四是多重平衡及其表格分析。
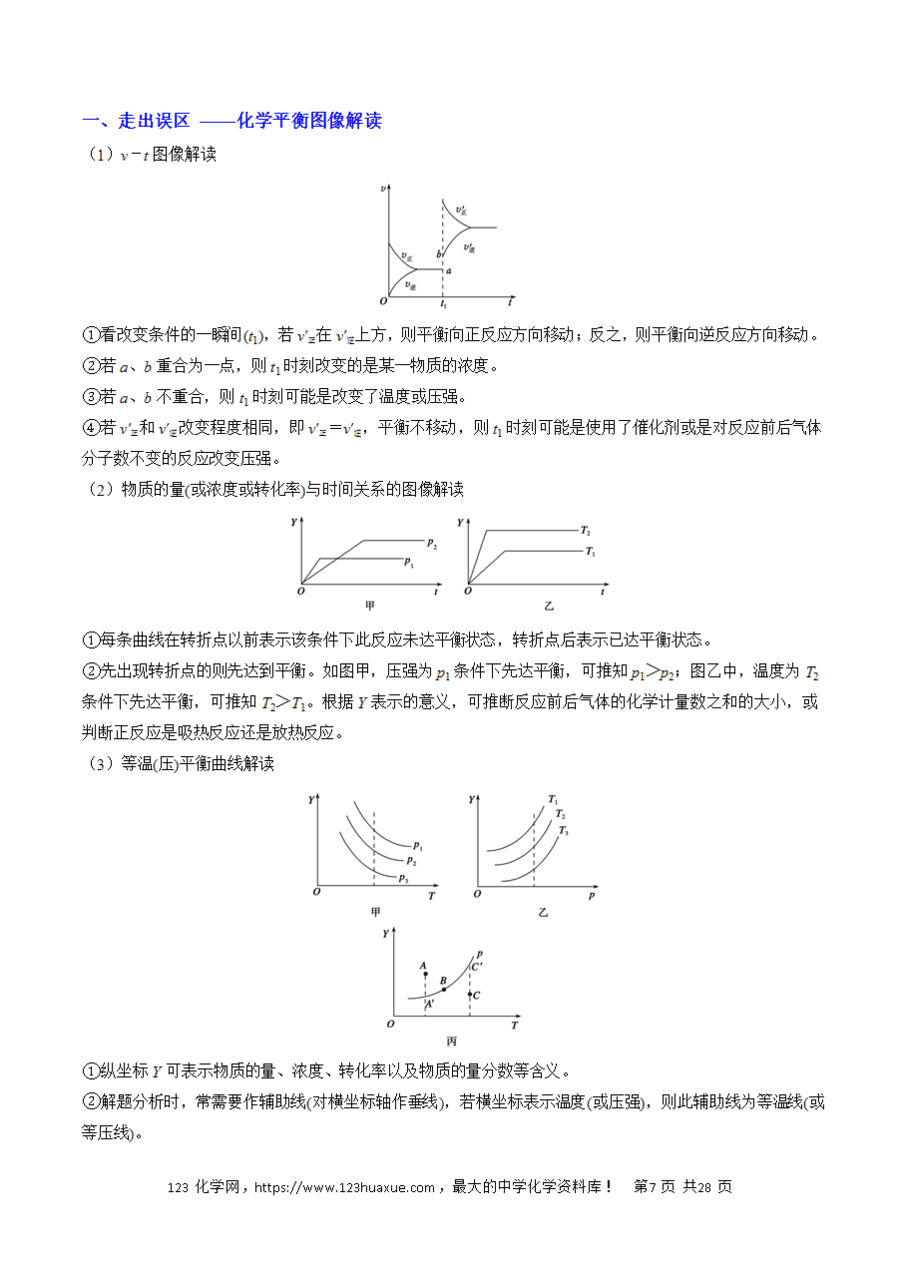
解答化学反应速率图像题的方法思路(1)看面:认清坐标系,搞清纵、横坐标所代表的意义,并与有关的原理相联系。
(2)看线:弄清线的走向、变化趋势及线的陡与平。
(3)看点:弄清曲线上点的含义,特别是一些特殊点,如起点、终点、交点、折点、最高点、最低点。例如,在浓度—时间图像中,一定要看清终点时反应物的消耗量、生成物的增加量,并结合有关原理进行推理判断。
(4)看变化趋势:在速率—时间图像上,要注意看清曲线是连续的还是跳跃的,分清渐变和突变、大变和小变。例如,升高温度,v(吸)大增,v(放)小增;增大反应物浓度,v(正)突变,v(逆)渐变。
3.解答化学平衡移动问题的步骤
1.正确分析反应特点:包括反应物、生成物的状态、气体体积变化、反应的热效应。
2.明确外界反应条件:恒温恒容、恒温恒压、反应温度是否变化、反应物配料比是否变化。
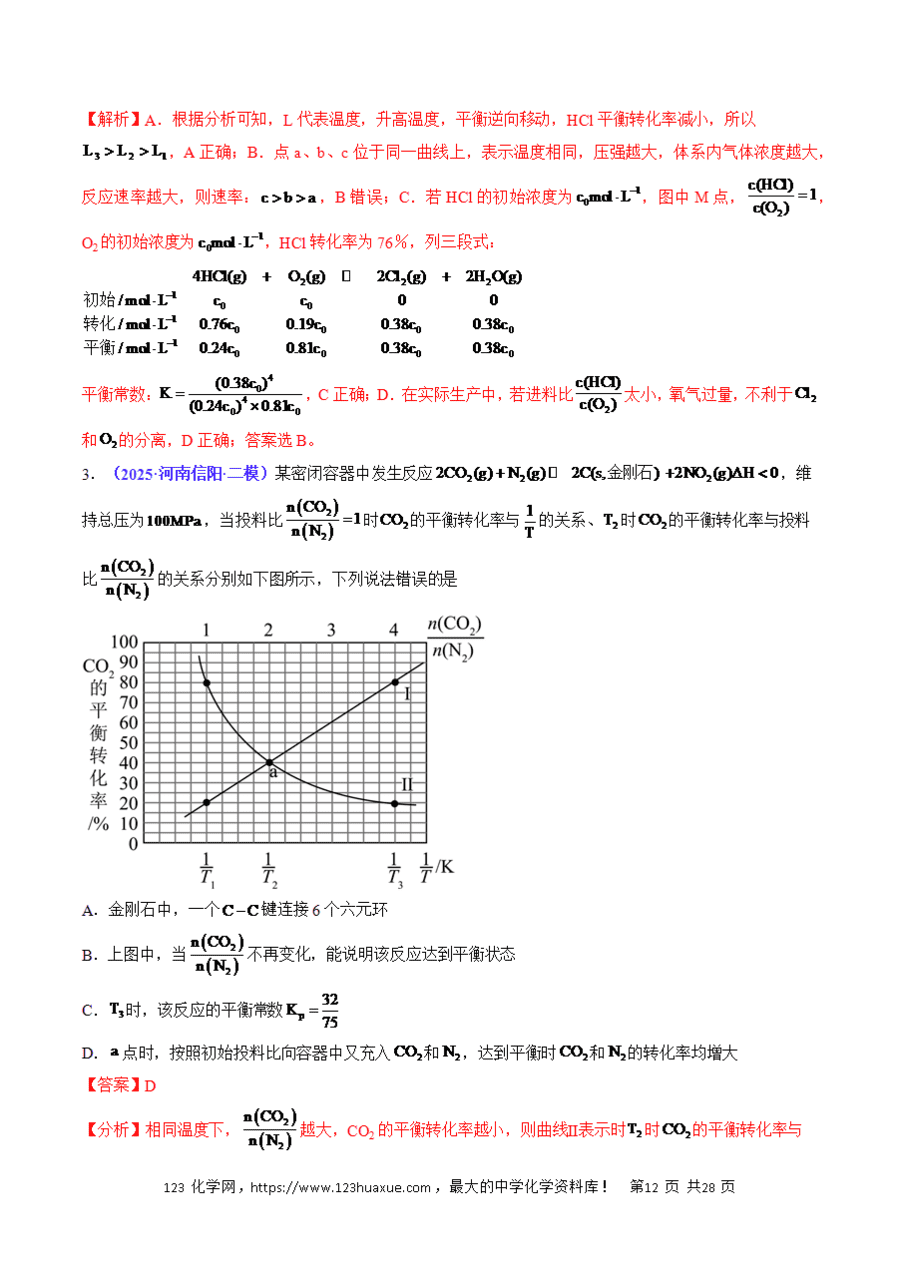
3.结合图像或K与Q的关系、平衡移动原理等,判断平衡移动的方向或结果。
(4)结合题意,运用“三段式”,分析计算、确定各物理量的变化。