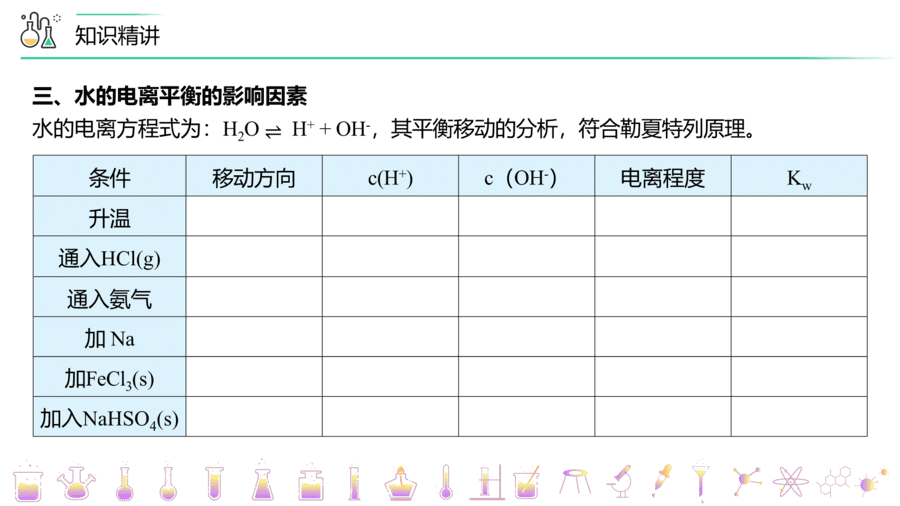
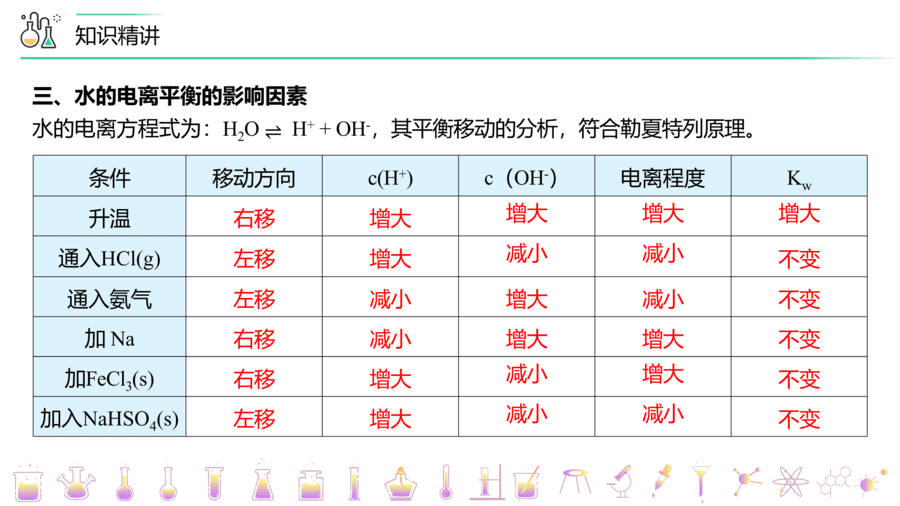
【题1】(防城港市实验高级中学高二期中)下列说法正确的是
A.水的电离方程式为H2O=H++OH- B.升高温度,水的电离程度增大
C.NaOH溶液中不存在H+ D.HCl溶液中不存在OH-
【答案】B
【详解】
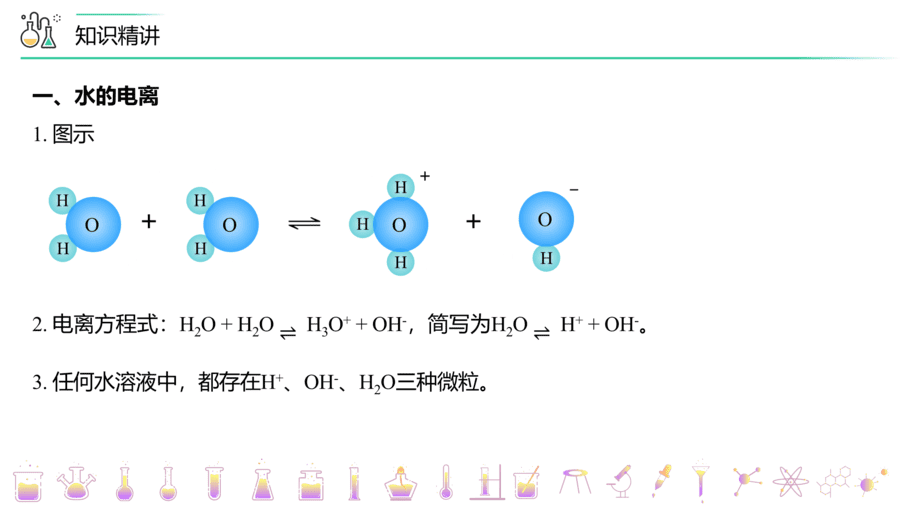
A.水是弱电解质,部分电离,电离方程式为H2O⇌H++OH-,故A错误;
B.水的电离属于吸热反应,升高温度,平衡向吸热反应方向移动,水的电离程度变大,故B正确;
C.任何水溶液中均存在水的电离,因此NaOH溶液中也存在H+,故C错误;
D.任何水溶液中均存在水的电离,因此HCl溶液中也存在OH-,故D错误;
故选B。
【题2】(福建省南安第一中学高二月考)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3NH4++NH2-,据此判断,以下叙述错误的是( )
A.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
B.液氨中含有NH3、NH4+、NH2-等粒子
C.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
D.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
【答案】C
【详解】
A选项,纯水中氢离子浓度与氢氧根浓度乘积是个常数,同理一定温度下液氨中c(NH4+)·c(NH2-)是一个常数,故A正确,不符合题意;
B选项,液氨是部分电离,因此液氨中含有NH3、NH4+、NH2-等粒子,故B正确,不符合题意;
C选项,液氨达到电离平衡,各离子浓度不变,不能说c(NH3)=c(NH4+),故C错误,符合题意;
D选项,液氨电离出NH4+、NH2-,只要不加入其他物质,液氨中c(NH4+)=c(NH2-),故D正确,不符合题意。
综上所述,答案为C。