分别写出浓H2SO4与Cu、C反应的化学方程式:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O、C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
(3)常温下,Fe、Al遇浓H2SO4钝化,可用铝槽车装运浓H2SO4。
(4)分别写出浓H2SO4与H2S、HI、FeSO4反应的化学方程式:H2S+H2SO4(浓)===S↓+SO2↑+2H2O、2HI+H2SO4(浓)I2↓+SO2↑+2H2O、2FeSO4+2H2SO4(浓)===Fe2(SO4)3+SO2↑+2H2O。
浓H2SO4与金属反应时的“量变”引起的“质变”规律
(1)较活泼金属(如Zn),开始产生SO2,浓度变小后产生H2。
(2)不活泼金属(如Cu),开始产生SO2(加热),浓度变小后,稀H2SO4不再与Cu反应。
2.硝酸的化学性质
(1)不稳定性
反应:4HNO3(浓)2H2O+4NO2↑+O2↑。
(2)强氧化性
硝酸无论浓、稀都具有强氧化性,而且浓度越大,氧化性越强。
按要求完成下列反应的方程式:
①与金属反应
稀硝酸与铜反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O;
浓硝酸与铜反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
②与非金属反应
浓硝酸与C反应:C+4HNO3(浓)CO2↑+4NO2↑+2H2O。
③与还原性化合物反应
硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。
稀硝酸与FeSO4溶液反应的离子方程式:
3Fe2++4H++NO===3Fe3++NO↑+2H2O。
(3)与有机物反应
①硝化反应(与反应):+HNO3浓硫酸△+H2O;
②显色反应:含有苯基的蛋白质遇到浓硝酸时变黄色。
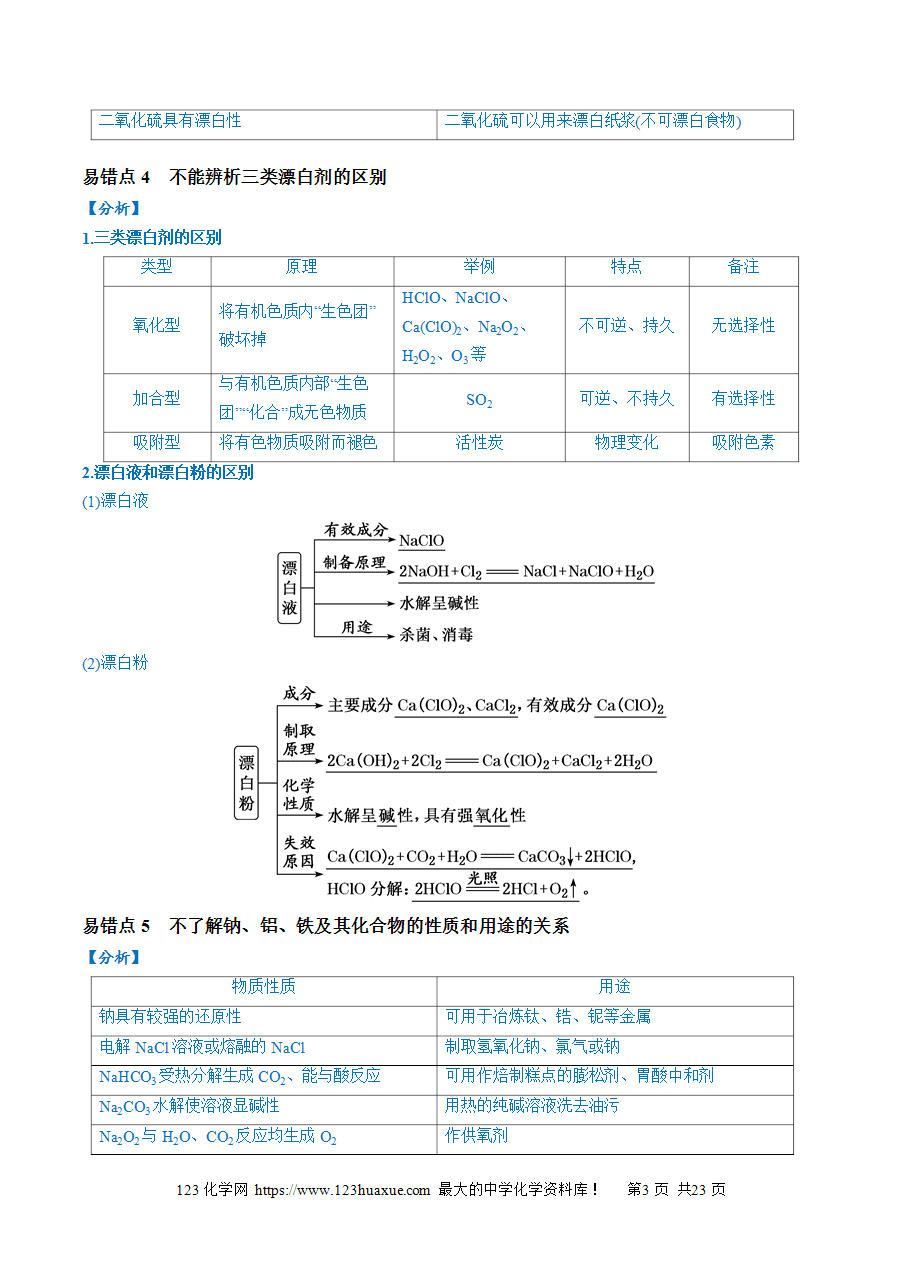
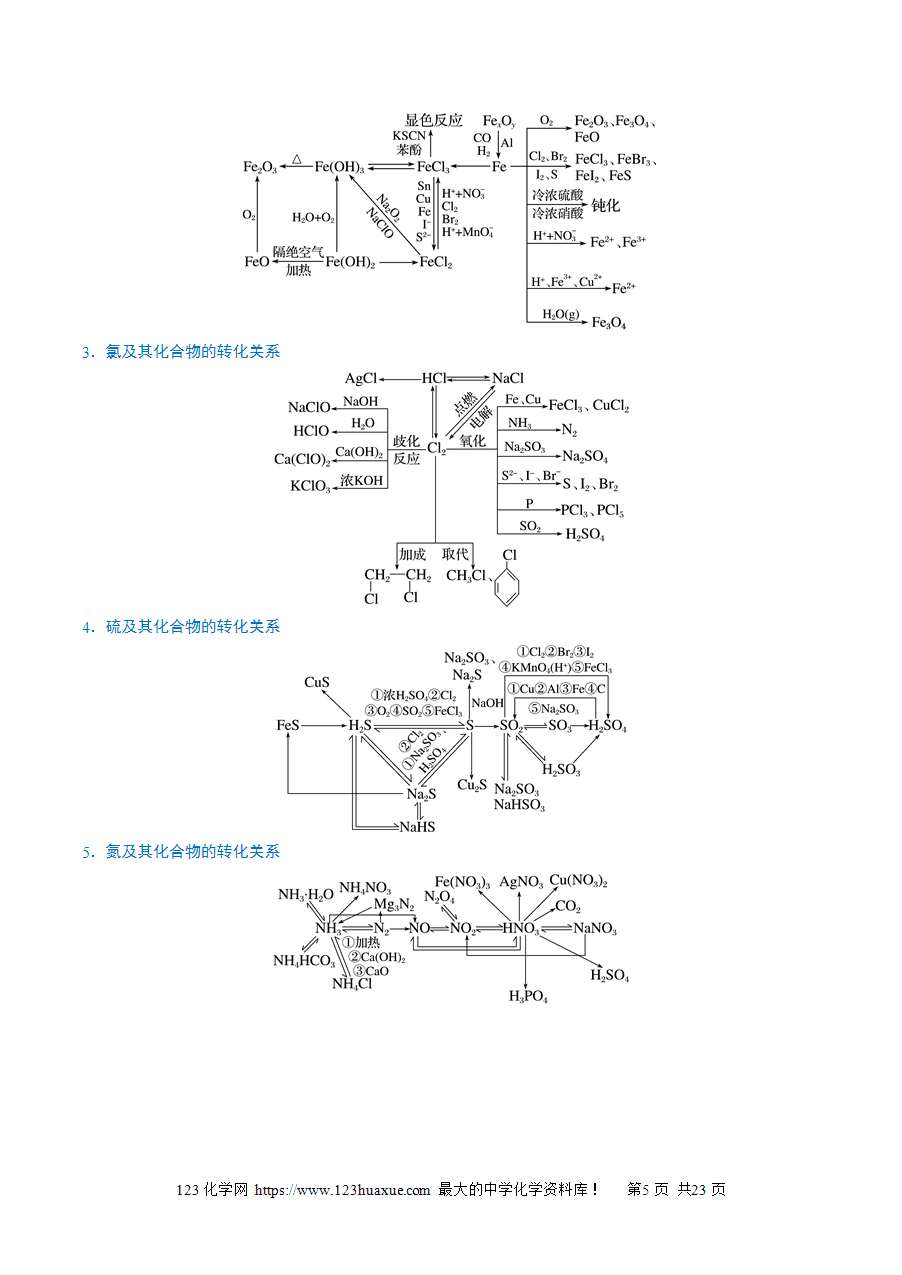
易错点2 不能区分硅与二氧化硅的性质与用途的关系