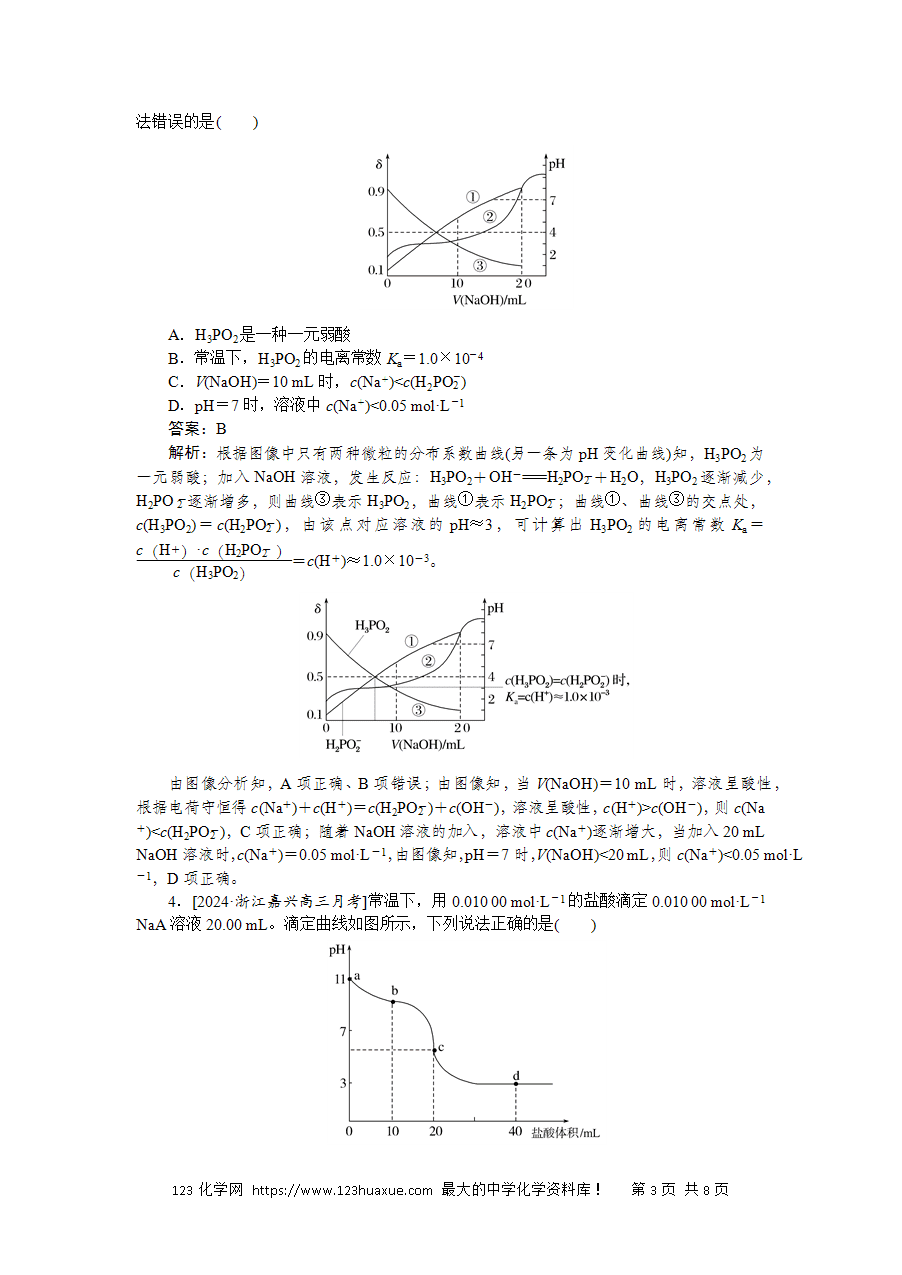
滴定曲线的综合应用
1.某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L-1 Na2CO3溶液和40 mL 0.2 mol·L-1 NaHCO3溶液,再分别用0.4 mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
下列说法正确的是( )
A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸
B.当滴加盐酸的体积为V1 mL时(a点、b点),所发生的反应用离子方程式表示为:
HCO+H+===CO2↑+H2O
C.根据pHV(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点
D.Na2CO3和NaHCO3溶液中均满足:
c(H2CO3)-c(CO)=c(OH-)-c(H+)
答案:C
解析:因为CO比HCO的水解程度大,且Na2CO3溶液浓度比NaHCO3溶液大,故Na2CO3溶液的初始pH较大,甲线表示向Na2CO3溶液中滴加盐酸,向Na2CO3溶液中滴加盐酸时,CO→HCO→H2CO3→CO2,开始加入盐酸时没有CO2产生,故丁线表示向Na2CO3溶液中滴加盐酸,A项错误;从图像可以看出,b点尚未放出CO2,此时反应的离子方程式是HCO+H+===H2CO3,B项错误;图像显示c点pH在8~10,则可以用酚酞作指示剂,d点pH在3~4,则可以用甲基橙作指示剂,C项正确;根据质子守恒,Na2CO3溶液中c(OH-)=c(H+)+c(HCO)+2c(H2CO3),D项错误。
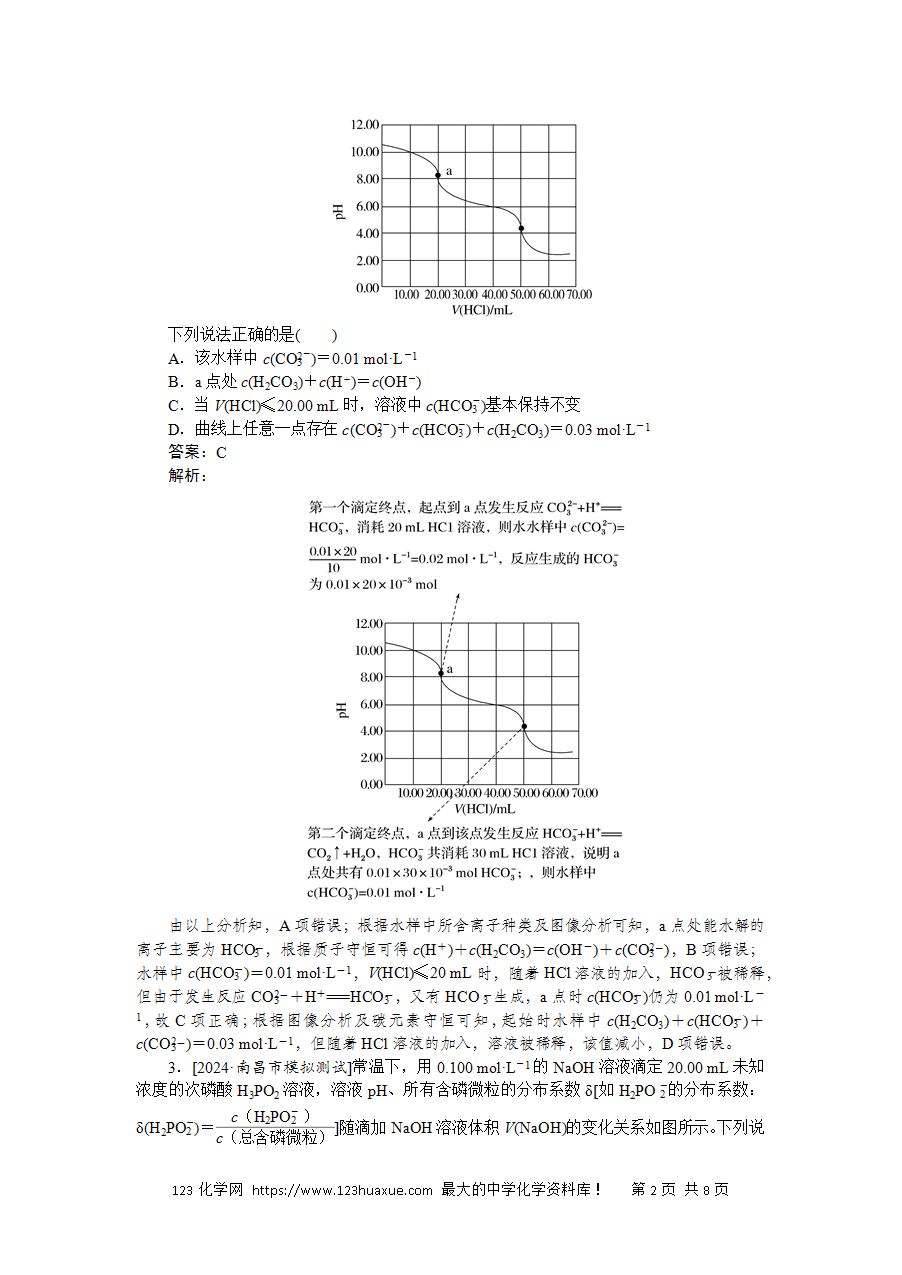
2.[2022·河北卷]某水样中含一定浓度的CO、HCO和其他不与酸碱反应的离子。取10.00 mL水样,用0.010 00 mol·L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。