反应历程(催化剂与化学反应)图及分析(图像13秒杀)-2025年高考化学选择压轴题图像专项突破秒杀技巧及专项练习(解析版)
化学反应机理(反应历程)图及分析秒杀思想
模型:特征:许多化学反应,尽管其反应方程式很简单,却不是基元反应,而是经由两个或多个步骤完成的复杂反应。
基础1:基元反应大多数化学反应都是分几步完成的,其中的每一步反应都称为基元反应。对于基元反应aA+bB===gG+hH,其速率方程可写为v=k·ca(A)·cb(B)(其中k称为速率常数,恒温下,k不因反应物浓度的改变而变化),这种关系可以表述为基元反应的化学反应速率与反应物浓度以其化学计量数为指数的幂的乘积成正比。
基础2:过渡态理论:
关键要点分析
①该反应的反应物为A、B,中间体为C,生成物为D。
②由A、B生成C的反应为吸热反应,由C生成D的反应为放热反应,总反应为放热反应。
③第一步为慢反应,第二步为快反应,决定总反应快慢的是第一步反应。
模型1:催化剂与化学反应
关键要点分析
①在无催化剂的情况下:E1为正反应的活化能;E2为逆反应的活化能;E1-E2为此反应的焓变(ΔH)。
②有催化剂时,总反应分成了两个反应步骤(也可能为多个,如模拟演练题1中图像所表示的),反应①为吸热反应,产物为总反应的中间产物,反应②为放热反应,总反应为放热反应。
③催化剂的作用:降低E1、E2,但不影响ΔH,反应是放热反应还是吸热反应取决于起点(反应物)能量和终点(生成物)能量的相对大小
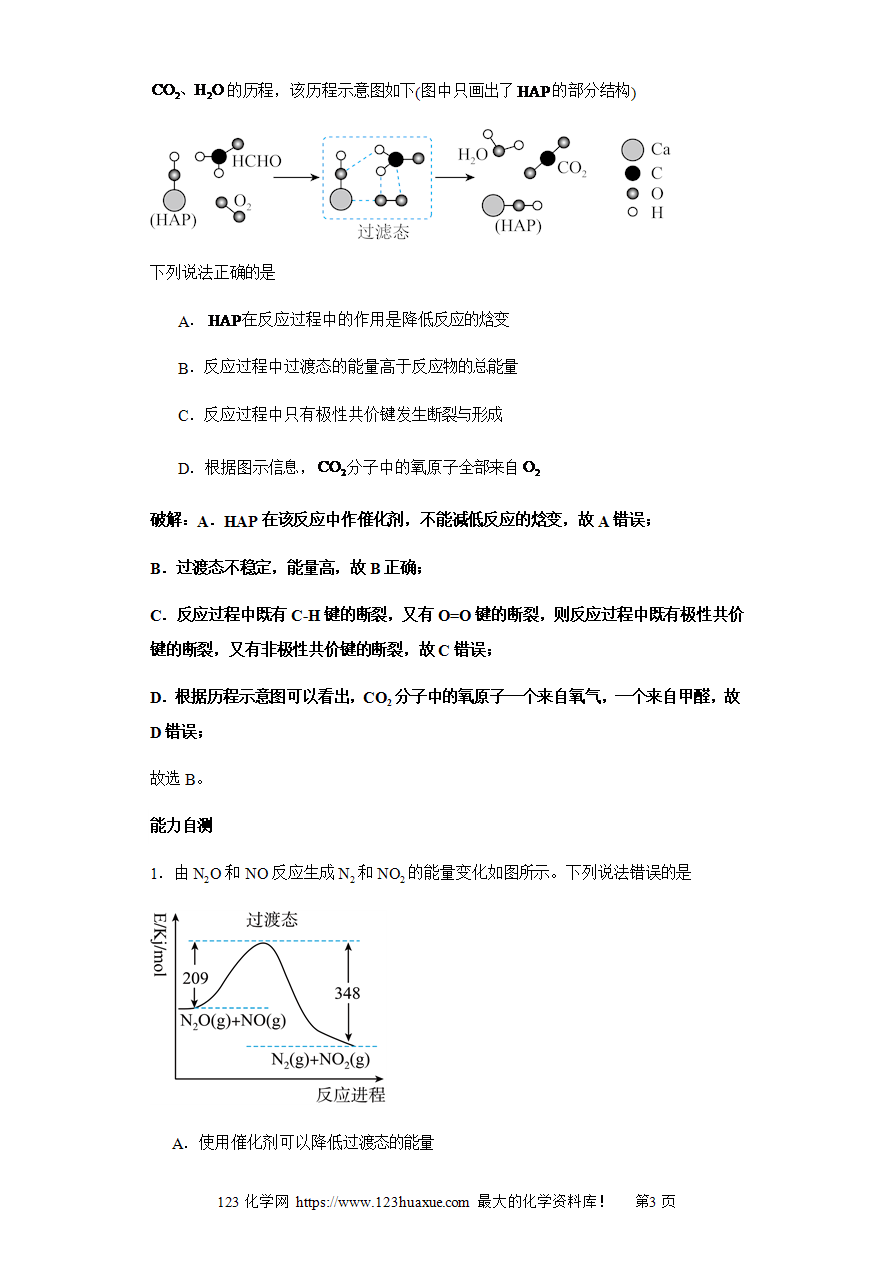
经典例题1:某反应过程中体系的能量变化如图所示,下列说法错误的是